Физика - Поурочные планы к учебникам Мякишева Г. Я. и Касьянова В. А. 11 класс
Электрический ток в электролитах - Поурочные разработки к учебнику В. А. Касьянова - Физика - Поурочные планы к учебникам Мякишева Г. Я. и Касьянова В. А. 11 класс - разработки уроков - авторские уроки - план-конспект урока
Цель: выяснить, какие частицы являются носителями тока в электролитах.
Ход урока
I. Организационный момент
II. Повторение
- Какие частицы являются носителями тока в газах?
- Как они получаются?
- Чем отличается самостоятельный разряд от несамостоятельного?
- За счет каких факторов поддерживается самостоятельный разряд?
- Какие виды самостоятельного разряда вы знаете?
- Что такое плазма?
- Приведите примеры вещества, находящегося в состоянии плазмы.
III. Проведение самостоятельной работы
1. Под действием ионизатора газ стал проводником, заряженный электроскоп, стоящий рядом, начинает быстро разряжаться. Почему после удаления ионизатора разряд прекращается?
A. Ионизатор разрядил электроскоп.
Б. В результате рекомбинации заряженные частицы быстро исчезают, превращаясь в нейтральные атомы, газ стал непроводником.
B. В газе будут только одноименные заряды.
2. Почему для уменьшения потерь электроэнергии на коронный разряд в линиях электропередач высокого напряжения применяют провода возможно большего диаметра?
A. Напряженность поля вблизи поверхности проводника увеличивается.
Б. Напряженность поля вблизи поверхности проводника не меняется.
B. Напряженность поля вблизи поверхности проводника уменьшается.
3. Какой вид разряда имеет место в лампах дневного света? Назовите носители зарядов при этом разряде.
A. Тлеющий: электроны, ионы газа и паров ртути.
Б. Коронный: электроны, ионы газа.
B. Искровой: электроны, ионы газа.
4. Как зависит проводимость газов от давления?
A. Не зависит.
Б. Чем больше давление, тем больше проводимость.
B. Чем больше давление, тем меньше проводимость.
5. Какие физические явления используются на ионизации газа:
1) Увеличение температуры.
2) Рентгеновские лучи.
3) Уменьшение давления.
4) Радиоактивность.
5) Ультрафиолетовое излучение?
A. 1, 2, 3, 5.
Б. 1, 2, 4, 5.
B. 1, 2, 3.
6. Сила тока насыщения в газе зависит:
1) От приложенного напряжения.
2) Действия ионизатора.
3) Объема между электродами.
A. 1.
Б. 1, 2.
B. 2, 3.
7. Плоский конденсатор, значение напряжения на котором близко к пробойному, отсоединили от источника тока. Наступит ли пробой, если пластины начать сближать?
A. Наступит.
Б. Не наступит.
B. Наступит, если пластины сближать с большой скоростью.
8. Коронный разряд поддерживается за счет
A. Ионизирующего излучения.
Б. Термоэлектронной эмиссии.
B. Высокой температуры газа.
Г. Высокой напряженности электрического поля.
9. Может ли возникнуть ток насыщения при самостоятельной проводимости газа?
А. Нет.
Б. Да.
(Ответы: 1. Б. 2. В. 3. А. 4. В. 5. Б. 6. В. 7. Б. 8. Г. 9. А.)
IV. Изучение нового материала
Эксперимент
К источнику тока соединили последовательно лампу и электролитическую ванну с дистиллированной водой, в которую опущены электроды. Замкнули цепь. Лампа не горит. Добавили в воду какую-нибудь соль (медный купорос). Лампа загорается.
Рассмотрев угольные электроды обнаружили характерный красный цвет (медь). При протекании тока через растворы электролитов вместе с зарядом всегда переносится вещество (электролиз). Носителями тока в этих проводниках являются ионы. В растворах электролитов всегда содержится некоторое число ионов. Если тока нет, они движутся беспорядочно. Но в электрическом поле положительные ионы движутся к катоду, отрицательные - к аноду.
Для растворов электролитов справедлив закон Ома.
При электролизе происходит выделение вещества:
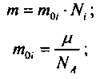
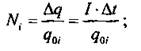
где µ - молярная масса; n - валентность; Ni - число ионов, достигших электрода; m0i - заряд одного иона.
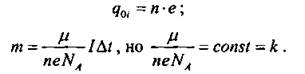
где k - электрохимический эквивалент, зависящий от вещества.
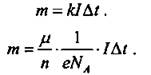
e · NA = F - число Фарадея.
F = 9,65 · 104 Кл/моль.
Для выделения 1 моля одновалентного вещества необходимо 9,65 · 104 Кл.
Отсюда можно найти заряд электрона:
![]()
Применение электролиза
1. Гальваностенки (никелирование, серебрение).
2. Гальванопластик (изготовление копий) (Б. С. Якоби, 1838 г.).
3. Электронатирание.
4. Очистка металлов, полученных при выплавке из руды, от прочих примесей.
5. Электротонировка поверхности.
V. Закрепление изученного материала
- Почему чистая вода не проводит электричество?
- Почему вода становится проводником при растворении соли?
- Что называется электрохимическим эквивалентом?
- Как можно определить заряд электротока?
VI. Решение задач
1. При серебрении изделия на катоде за 30 мин. отложилось серебро массой 4,55 г. Определите силу тока при электролизе. (Ответ: I ≈ 2,26 А.)
2. Сколько никеля выделится при электролизе за 1 час при силе тока 10 А, если известно, что молярная масса никеля 0,0587 кг/моль, а валентность n = 2? (Ответ: 11 час.)
3. При электролизе раствора ZnSO4 была затрачена энергия 20 кВт·ч. Определите массу выделившегося цинка, если напряжение на зажимах ванны 4 В. (Ответ: 612 г.)
4. Определите массу серебра, выделившегося на катоде при электролизе азотнокислого серебра за время 2 час, если к ванне приложено напряжение 1,2 В, а сопротивление ванны 5 Ом. (Ответ: m = 1,9 г.)
5. Определите толщину слоя меди, выделившейся за 5 час при электролизе медного купороса, если плотность тока 0,8 А/дм2. (Ответ: h = 5,3 · 10-5 м.)
Домашнее задание
п. 16;
Задачи № 379-382.