Физика - Поурочные разработки 11 класс - 2017 год
Теория Бора - АТОМНАЯ ФИЗИКА - КВАНТОВАЯ ФИЗИКА
Задачи урока: изучить постулаты Бора, описывающие основные свойства атома; познакомить с личностью этого замечательного учёного, его смелыми и революционными работами, положившими начало новой физической теории; продолжить формирование умений выделять и описывать физические явления.
Ход урока
I. Проводят фронтальную беседу по изученному на предыдущем уроке материалу. Вызванный ученик готовится по карточке с вопросами и отвечает у доски.
II. Краткое содержание рассказа учителя по новому материалу.
1. Открытие ядра атома поставило перед физиками ряд вопросов. Если применять к движению электрона внутри атома законы классической механики и электродинамики, то планетарная модель при объяснении происходящих в атоме явлений приводит к серьёзным противоречиям. Под действием притяжения к ядру электрон может двигаться по окружности с центростремительным ускорением, которое можно рассчитать из второго закона Ньютона:
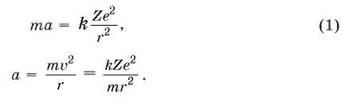
Из электродинамики известно, что ускоренно движущийся заряд излучает электромагнитные волны, т. е. атом должен излучать свет и в результате терять энергию. Потеря энергии приведёт к уменьшению скорости электрона и расстояния до ядра, равенство (1) — условие устойчивости орбиты — нарушится, электрон упадёт на ядро, а атом прекратит своё существование. В действительности атомы излучают свет, но не исчезают при этом — время их жизни очень велико.
Кроме того, частота излучения атома должна в соответствии с классической электродинамикой быть равной частоте обращения электрона вокруг ядра. Последняя же по мере торможения электрона в связи с потерей энергии на излучение должна плавно изменяться. Однако опыт показывает, что атомы испускают свет строго определённых частот.
Таким образом, классические законы к планетарной модели атома неприменимы. Нетрудно понять почему: ведь электрон — микрочастица, к которой неприменимы некоторые законы классической физики. В частности, мы знаем, что при движении электрон проявляет волновые свойства, а они в приведённых выше рассуждениях не учтены.
2. Следующий шаг в познании строения и физических свойств атомов был сделан датским физиком Нильсом Бором. Он предложил модель атома на основе двух постулатов.
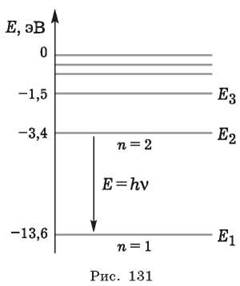
Согласно первому постулату возможны состояния микросистем с дискретными значениями энергии. На рисунке 131 изображены дискретные значения энергии возможных стационарных состояний атома водорода. Согласно второму постулату в микромире возможны переходы между такими состояниями, сопровождающиеся по закону сохранения энергии излучением или поглощением квантов энергии электромагнитных волн.
3. Учитель может оживить изложение, сообщая некоторые исторические сведения. Бор с самого начала, как пишет Б. Клайн, чётко поставил вопросы: “А нельзя ли с помощью квантовой гипотезы разрешить и проблему строения атома? Не существуют ли другие ограничения значений энергии, которые объяснят, почему вещество в обычных условиях не светится и почему электрон не падает на ядро?” [13, с. 98].
С этими вопросами связан и другой, более конкретный: “Какое же отношение имеет к частоте излучаемого света частота вращения электрона вокруг ядра?” Ответ Бора был: “Никакого”. Этот ответ в корне противоречил представлениям классической физики. А. Эйнштейн высоко оценил решение Бора: “Так, значит, частота излучаемого света вообще не зависит от частоты вращения электрона!.. Это огромное завоевание...” [9, с. 84].
Н. Бор сформулировал свои постулаты в 1913 г. В заключении своей классической работы “О строении атомов и молекул” он писал: “1) Энергия излучения испускается (или поглощается) не непрерывным образом, как это принимается в обычной электродинамике, а только лишь во время перехода системы между различными “стационарными” состояниями. 2) Динамическое равновесие систем в стационарных состояниях определяется обычными законами механики, но эти законы несправедливы для перехода систем между различными стационарными состояниями. 3) Излучение, испускаемое во время перехода системы между двумя стационарными состояниями, однородно, а соотношение между частотой v и полной испущенной энергией Е имеет вид E = hv, где h — постоянная Планка. 4) Различные стационарные состояния простой системы, состоящей из положительного ядра и электрона, вращающегося вокруг него, определяются условием, согласно которому отношение полной энергии, испущенной при изменении конфигурации, к частоте обращения электрона является целым кратным величины 1/2h...” [11, с. 88—89].
4. Теория Бора не сняла, но на время сгладила противоречия между классическими и квантовыми представлениями о строении атома, так как она использовала и те и другие. В частности, было непонятно, что лежит в основе квантовых переходов электрона с орбиты на орбиту.
Э. Резерфорд, прочитав работу Бора, писал: “Ваши взгляды на механизм рождения водородного спектра очень остроумны и кажутся отлично разработанными. Однако сочетание идей Планка со старой механикой делает весьма затруднительным понимание того, что же лежит в основе такого механизма...” [9, с. 84].
Данная цитата ещё с одной стороны характеризует атмосферу времён создания квантовой теории: глубокое проникновение в суть происходящих явлений осуществлялось в дискуссиях, в спорах.
5. Далее рассматривают следствия постулатов Бора. Сначала надо найти частоту электромагнитных волн, которые может излучать или поглощать атом. Энергия излучаемого фотона есть разность уровней энергии
![]()
По формуле Планка—Эйнштейна ε = hv, откуда
![]()
Рассматривая рисунок уровней энергии атома водорода, отмечают, что атом может испускать свет только определённых частот.
Итак, постулаты Бора отражают свойства реальных атомов — устойчивость их в стационарных состояниях и излучение определённых частот. В то же время они содержат новую и важную информацию о любых системах микрочастиц: эти системы могут иметь дискретные уровни энергии, могут совершать переходы — квантовые скачки.
III. В конце урока повторяют и углубляют изученное. Для этого можно разобрать с учащимися диаграммы энергетических уровней атома водорода (см. рис. 131). Учитель подчёркивает, что эта диаграмма рассчитана в современной теории и проверена с помощью измерений на опытах; разъясняет, что в низшем энергетическом состоянии электрон может находиться сколь угодно долго, не излучая энергию вопреки законам классической физики. Поглотить же энергию он может, при этом перейдёт в одно из изображённых на диаграмме возбуждённых состояний. Следует рассчитать (в электронвольтах) энергию, которую нужно сообщить атому для таких переходов.
Приведём примеры вопросов и задач для коллективного решения.
1. В каком состоянии энергия электрона меньше: в основном или в возбуждённом?
2. Определите наименьшую энергию, которую надо сообщить атому водорода, чтобы перевести его в ионизированное состояние.
3. Сколько квантов с различной энергией может испустить атом водорода, если он находится в третьем энергетическом состоянии?
4. Чем отличается модель атома по Бору от модели атома по Резерфорду?
5. Какие новые закономерности микромира открыл Н. Бор? Почему они были сформулированы в виде постулатов? Чем они противоречат классическим представлениям?
Научное творчество Н. Бора не сводится к созданию только теории водородоподобного атома. Он внёс значительный вклад в понимание закономерностей всей квантовой механики. Можно познакомить школьников с выдвинутыми Бором принципом дополнительности и принципом соответствия. Для этого лучше всего использовать материал книги.
“Бор считает принцип неопределённости следствием более общего принципа, принципа дополнительности, согласно которому нельзя в одном эксперименте обнаружить и волновые и корпускулярные свойства материи. <...> Поэтому волновые и корпускулярные свойства нужно считать не противоречащими друг другу, а дополняющими друг друга” (Кузнецов Б. Г. Развитие физических идей от Галилея до Эйнштейна в свете современной науки. — М.: Либроком, 2010).
Для более полного представления принципа дополнительности используется энциклопедия: “Получение экспериментальной информации об одних физических величинах, описывающих микрообъект (элементарную частицу, атом, молекулу), неизбежно связано с потерей информации о некоторых других величинах — дополнительных к первым. Такими взаимно дополнительными величинами являются, например, координата частицы и её скорость (или импульс)... С физической точки зрения принцип дополнительности объясняют (следуя Бору) влиянием измерительного прибора (который всегда является макроскопическим объектом) на состояние микрообъекта. При точном измерении одной из дополнительных величин (например, координаты частицы) с помощью соответствующего прибора другая величина (импульс) в результате взаимодействия частицы с прибором претерпевает такое изменение, что её последующее измерение вообще теряет смысл” [23, с. 170].
В понимании соотношения между классической механикой и квантовой важная роль принадлежит принципу соответствия, сформулированному Бором в 1923 г. Для подготовки докладов учащиеся могут использовать статью В. А. Угарова “Классическая и квантовая механика” из книги “Школьникам о современной физике. Физика сложных систем” (М.: Просвещение, 1978. — С. 112—128). Принцип соответствия гласит: “При переходе к пределу h → 0, т. е. в предположении, что эффектами, пропорциональными квантовой постоянной h, можно пренебречь, законы и соотношения квантовой механики переходят в соответствующие законы и соотношения классической механики”. Следовательно, квантовая механика в применении к явлениям макромира должна приводить к законам классической механики. Принцип соответствия помогает как в поиске важных соотношений квантовой физики, так и в физической интерпретации установленных законов.
IV. Домашнее задание: § 75; упр. на с. 288 (ЕГЭ); упр. на с. 297 (1, 2).