Физика: Универсальный справочник
Основы молекулярно-кинетической теории - Молекулярная физика - МОЛЕКУЛЯРНАЯ ФИЗИКА. ТЕРМОДИНАМИКА
Молекулярная физика описывает строение вещества с помощью молекулярно-кинетической теории.
Согласно молекулярно-кинетической теории (МКТ), все тела состоят из отдельных частиц — молекул и атомов, то есть не являются сплошными.
Основные положения молекулярно-кинетической теории строения вещества заключаются в следующем:
1) вещество состоит из частиц (атомов и молекул);
2) эти частицы беспорядочно движутся;
3) частицы взаимодействуют друг с другом.
Атом — это наименьшая часть химического элемента, обладающая его свойствами и способная к самостоятельному существованию.
Каждому элементу соответствует определенный род атомов, обозначаемый химическим символом этого элемента. Например, атом кислорода обозначается символом О, водорода — Н, гелия — Не и т. д.
Атомы могут существовать в свободном состоянии (в виде отдельных атомов) в газах. В жидкостях и твердых телах они существуют в виде молекул, в которых соединяются с атомами того же элемента или других химических элементов (или, как принято говорить, существуют в связанном состоянии).
Молекула — мельчайшая устойчивая частица вещества, состоящая из атомов одного или нескольких химических элементов, сохраняющая основные химические свойства этого вещества. Атомы можно рассматривать как одноатомные молекулы.
Размеры молекул
Для определения размеров молекул проводились различные опыты. Вот один из них.
В сосуд с водой помещают каплю масла, объем которой определяется заранее. (Объем капли V определяют с помощью мензурки, в которую при помощи пипетки капают несколько десятков капель масла, и измеряют их общий объем. Этот объем делят на количество капель). Масло начинает растекаться по поверхности воды, образуя тонкую пленку. После прекращения растекания пленки определяют ее площадь S. Если предположить, что образовалась пленка толщиной в одну молекулу (из-за чего и прекратилось растекание масла), то толщина пленки h будет равна диаметру молекулы. Толщина пленки равна отношению ее объема к площади:
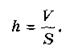
Полученное в этом опыте численное значение толщины составляло 0,00000016 см, или 1,6 · 10-7см. Этим числом выражается примерный размер молекул (размеры атомов составляют около 10 -8 см).
Поскольку молекулы очень малы, в каждом физическом теле их содержится огромное количество. Так, в 1 см3 воздуха содержится около 27 · 1018 молекул. Чтобы понять, насколько велико это число, представим себе, что через маленькое отверстие пропускают по миллиону молекул в секунду, тогда указанное количество молекул пройдет через отверстие за 840 000 лет.
Масса молекул
Масса молекул (за исключением молекул органических веществ, например, белков) очень мала. Так, масса молекулы воды составляет около 2,7 · 1023 г. Работать с такими малыми цифрами неудобно, поэтому в физике и химии принято выражать массы атомов и молекул в относительных единицах.
Атомная единица массы
Атомная единица массы (а.е.м.) — единица массы, равная 1/12 массы атома изотопа углерода 12С:
![]()
Чтобы перевести значение массы атомов или молекул, выраженной в а.е.м., т. е. относительную молекулярную (или атомную) массу вещества Мг, в единицу массы СИ (кг), пользуются формулой:
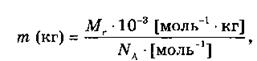
где NA — постоянная Авогадро.
Атомная масса (относительная молекулярная масса)
Относительная молекулярная масса (атомная масса) относительное значение массы молекулы (атома), выраженное в атомных единицах массы:

где Мг — относительная молекулярная (атомная) масса; m0 — масса молекулы (атома), выраженная в единицах СИ (кг); moc — масса молекулы изотопа углерода 12С, выраженная в тех же единицах, что и mo.

Атомная масса была взята Д. И. Менделеевым за основную характеристику элемента при открытии им периодической системы элементов. Атомная масса — дробная величина, в отличие от массового числа — количества нуклонов в атоме.
Относительная молекулярная масса вещества складывается из относительных атомных масс (а.м.) входящих в молекулу элементов. Например:
![]()
Атомные массы всех химических элементов точно измерены.
Моль. Постоянная Авогадро
Моль — количество вещества, масса которого, выраженная в граммах, численно равна относительной атомной (молекулярной) массе.
Моль — единица количества вещества в СИ (одна из основных единиц СИ).
В 1 моле содержится столько молекул (атомов или других частиц вещества), сколько атомов содержится в 0,012 кг нуклида углерода 12С с атомной массой 12.
Из этого определения следует, что в одном моле любого вещества содержится одно и то же число атомов или молекул.
Число это называется постоянной Авогадро и обозначается NА:
![]()
Постоянная Авогадро (число Авогадро) — это число атомов (молекул, или других структурных элементов вещества), содержащихся в 1 моле.
Постоянная Авогадро — одна из фундаментальных физических констант. Она входит в некоторые другие постоянные, например, в постоянную Больцмана.
Количество вещества
Количество вещества — это число частиц вещества (атомов, молекул), выраженное в молях. Учитывая определение моля и числа Авогадро, можно сказать, что количество вещества v равно отношению числа молекул N в данном теле к постоянной Авогадро NA, т. е. к числу молекул в 1 моле вещества:

Молярная масса
Молярной массой вещества М называют массу вещества, взятого в количестве 1 моль:
![]()
где m0 — масса молекулы данного вещества.
Поскольку для любого тела его масса т связана с количеством молекул N в нем соотношением
![]()
то из (2.1), (2.2) и (2.3) получим:
![]()
Количество вещества равно отношению массы вещества к его молярной массе. Из (2.4) и (2.1) получаем:

выражение для числа молекул в теле с массой m и молярной массой М.