Физика: Универсальный справочник
Внутренняя энергия - Термодинамика - МОЛЕКУЛЯРНАЯ ФИЗИКА. ТЕРМОДИНАМИКА
Внутреннюю энергию тела составляют кинетическая энергия всех его молекул и потенциальная энергия их взаимодействия.
Внутренняя энергия входит в баланс энергетических превращений в природе. После открытия внутренней энергии был сформулирован закон сохранения и превращения энергии. Рассмотрим взаимное превращение механической и внутренней энергий. Пусть на свинцовой плите лежит свинцовый шар. Поднимем его вверх и отпустим. Когда мы подняли шар, то сообщили ему потенциальную энергию. При падении шара она уменьшается, т. к. шар опускается все ниже и ниже. Но с увеличением скорости постепенно увеличивается кинетическая энергия шара. Происходит превращение потенциальной энергии шара в кинетическую. Но вот шар ударился о свинцовую плиту и остановился. И кинетическая, и потенциальная энергии его относительно плиты стали равными нулю. Рассматривая шар и плиту после удара, мы увидим, что их состояние изменилось: шар немного сплющился, и на плите образовалась небольшая вмятина; измерив же их температуру, мы обнаружим, что они нагрелись.
Нагрев означает увеличение средней кинетической энергии молекул тела. При деформации изменяется взаимное расположение частиц тела, поэтому изменяется и их потенциальная энергия.
Таким образом, можно утверждать, что в результате удара шара о плиту происходит превращение механической энергии, которой обладал в начале опыта шар, вовнутреннюю энергию тела.
Нетрудно наблюдать и обратный переход внутренней энергии в механическую.
Например, если взять толстостенный стеклянный сосуд и накачать в него воздух через отверстие в пробке, то спустя какое-то время пробка из сосуда вылетит. В этот момент в сосуде образуется туман. Появление тумана означает, что воздух в сосуде стал холоднее и, следовательно, его внутренняя энергия уменьшилась. Объясняется это тем, что находившийся в сосуде сжатый воздух, выталкивая пробку (т. е. расширяясь), совершил работу за счет уменьшения своей внутренней энергии. Кинетическая энергия пробки увеличилась за счет внутренней энергии сжатого воздуха.
Таким образом, одним из способов изменения внутренней энергии тела является работа, совершаемая молекулами тела (или другими телами) над данным телом. Способом изменения внутренней энергии без совершения работы является теплопередача.
Внутренняя энергия идеального одноатомного газа
Поскольку молекулы идеального газа не взаимодействуют друг с другом, их потенциальная энергия считается равной нулю. Внутренняя энергия идеального газа определяется только кинетической энергией беспорядочного поступательного движения его молекул. Для ее вычисления нужно умножить среднюю кинетическую энергию одного атома ![]() =
= ![]() на число атомов N =
на число атомов N = ![]() . Учитывая, что kNA = R, получим значение внутренней энергии идеального газа:
. Учитывая, что kNA = R, получим значение внутренней энергии идеального газа:
![]()
Внутренняя энергия идеального одноатомного газа прямо пропорциональна его температуре. Если воспользоваться уравнением Клапейрона-Менделеева, то выражение для внутренней энергии идеального газа можно представить в виде:
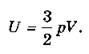
Следует отметить, что, согласно выражению для средней кинетической энергии одного атома (![]() =
= ![]() и в силу хаотичности движения, на каждое из трех возможных направлений движения, или каждую степень свободы, по оси X, Y и Z приходится одинаковая энергия
и в силу хаотичности движения, на каждое из трех возможных направлений движения, или каждую степень свободы, по оси X, Y и Z приходится одинаковая энергия ![]() .
.
Число степеней свободы — это число возможных независимых направлений движения молекулы.
Газ, каждая молекула которого состоит из двух атомов, называется двухатомным. Каждый атом может двигаться по трем направлениям, поэтому общее число возможных направлений движения — 6. За счет связи между молекулами число степеней свободы уменьшается на одну, поэтому число степеней свободы для двухатомной молекулы равно пяти.
Средняя кинетическая энергия двухатомной молекулы равна ![]() Соответственно внутренняя энергия идеального двухатомного газа равна:
Соответственно внутренняя энергия идеального двухатомного газа равна:
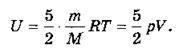
Формулы для внутренней энергии идеального газа можно обобщить:
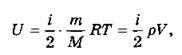
где i — число степеней свободы молекул газа (i = 3 для одноатомного и i = 5 для двухатомного газа).
Для идеальных газов внутренняя энергия зависит только от одного макроскопического параметра — температуры и не зависит от объема, т. к. потенциальная энергия равна нулю (объем определяет среднее расстояние между молекулами).
Для реальных газов потенциальная энергия не равна нулю. Поэтому внутренняя энергия в термодинамике в общем случае однозначно определяется параметрами, характеризующими состояние этих тел: объемом (V) и температурой (Т).