Уроки Биологии в 10(11) классе развернутое планирование
БИОПОЛИМЕРЫ. СТРОЕНИЕ БЕЛКОВ - ХИМИЧЕСКИЙ СОСТАВ КЛЕТКИ - КЛЕТКА — ЕДИНИЦА ЖИВОГО
На изучение темы «Белки» целесообразно отвести два урока. На первом уроке изучить состав, образование, строение и структуры белков, на втором — свойства и функции белков.
Задачи. Продолжить изучение органических веществ клетки. Сформировать знания о химическом составе, образовании и строении белков. Дать характеристику основным структурам белковых молекул. Повторить материал и проконтролировать знания учащихся по теме «Углеводы. Липиды».
Оборудование. Демонстрационный материал: таблицы по общей биологии, отрезок гибкого провода длиной около 1 м, модель первичной структуры белка — разноцветные шарики-бусинки на нитке, кодограмма (приложение 1).
Ход урока:
Повторение. Письменная работа с карточками на 10 мин.
1. Дайте характеристику регулярным и нерегулярным полимерам.
2. Строение и функции глюкозы, крахмала, гликогена и целлюлозы.
3. Какие функции выполняют жиры в организме? Приведите примеры.
Работа с карточкой у доски: приложение 2.
Компьютерное тестирование: приложение 3.
Устное повторение.
Изучение нового материала. Объяснение с помощью таблиц, кодограммы (приложение 1).
Состав и строение белков. Из органических веществ клетки по количеству и значению на первом месте стоят белки. Белки — высокомолекулярные органические вещества, состоящие из остатков α-аминокислот.
В состав белков входят: углерод, водород, азот, кислород, сера. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь.
Белки обладают большой молекулярной массой: молекулярная масса альбумина (одного из белков яйца) — 36 000, гемоглобина — 152 000, миозина (одного из белков мышц) — 500 000. Для сравнения: молекулярная масса спирта — 46, уксусной кислоты — 60, бензола — 78.
Белки являются непериодичными полимерами, мономерами которых являются аминокислоты. В клетках и тканях обнаружено свыше 170 различных аминокислот, но в состав белков входит лишь 26. Причем 6 из них являются нестандартными. Они образуются в результате модификации стандартных аминокислот уже после их включения в полипептидную цепь. Поэтому обычными компонентами белков считают лишь 20 α-аминокислот.
В зависимости от того, могут ли аминокислоты синтезироваться в организме, различают: заменимые аминокислоты — десять аминокислот, синтезируемых в организме; незаменимые аминокислоты — аминокислоты, которые в организме не синтезируются. Незаменимые аминокислоты должны поступать в организм вместе с пищей.
В зависимости от аминокислотного состава белки бывают: полноценными, если содержат весь набор аминокислот; неполноценными, если какие-то аминокислоты в их составе отсутствуют. Различают простые белки, состоящие только из аминокислот (фибрин, трипсин), и сложные белки, содержащие помимо аминокислот еще и небелковую — простетическую группу. Она может быть представлена ионами металлов (металлопротеины — гемоглобин), углеводами (гликопротеины), липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины).
Все аминокислоты содержат хотя бы одну карбоксильную группу (—СООН) и одну аминогруппу (—NH2). Остальная часть молекулы представлена R-группой. В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают: нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу; основные аминокислоты, имеющие более одной аминогруппы; кислые аминокислоты, имеющие более одной карбоксильной группы.
Аминокислоты являются амфотерными соединениями, так как в растворе они могут выступать как в роли кислот, так и оснований. В водных растворах аминокислоты существуют в разных ионных формах. Это зависит от pH раствора и от того, какая аминокислота: нейтральная, кислая или основная.
Пептиды — органические вещества, состоящие из остатков аминокислот, соединенных пептидной связью. Образование пептидов происходит в результате реакции конденсации аминокислот. При взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой, между ними возникает ковалентная азот-углеродная связь, которую называют пептидной. В зависимости от количества аминокислотных остатков, входящих в состав пептида, различают дипептиды, трипептиды, тетрапептиды и т. д. Образование пептидной связи может повторяться многократно. Это приводит к образованию полипептидов. На одном конце молекулы находится свободная аминогруппа (его называют N-концом), а на другом — свободная карбоксильная группа Сего называют С-концом).
Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул. Кроме того, клетке энергетически невыгодно держать белки в развернутой форме — в виде цепочки. Поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Образование компактных конформаций возможно благодаря возникновению внутримолекулярных и межмолекулярных связей (прежде всего водородных), возникающих между различными группировками аминокислотных остатков полипептидных цепей, а также в результате гидрофобных взаимодействий между неполярными радикалами. Выделяют 4 уровня пространственной организации белков.
Под первичной структурой белка понимают последовательность расположения аминокислотных остатков в одной или нескольких полипептидных цепях, составляющих молекулу белка. Первым белком, у которого была выявлена аминокислотная последовательность, стал гормон инсулин. Исследования проводились в Кембриджском университете Ф. Сэнгером с 1944 по 1954 год. Было выявлено, что молекула инсулина состоит из двух полипептидных цепей (21 и 30 аминокислотных остатков), удерживаемых около друг друга дисульфидными мостиками. За свой кропотливый труд Ф. Сэнгер был удостоен Нобелевской премии.
В организме человека обнаружено порядка 10 тыс. различных белков, которые отличаются как друг от друга, так и от белков других организмов. Имея всего лишь 20 аминокислот, можно составить из них огромное количество самых разнообразных комбинацией. Так, если молекула белка состоит всего из 10 аминокислотных остатков, то число теоретически возможных вариантов белковых молекул, отличающихся порядком чередования аминокислот, — 1020. Белки же, выделенные из живых организмов, образованы сотнями, а иногда и тысячами аминокислотных остатков.
Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Лишь незначительное количество белков имеет строго линейную структуру. Основная масса белков подвергается дальнейшей укладке, что приводит к образованию вторичной структуры белковой молекулы.
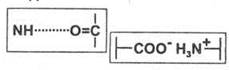
Вторичной структурой называют упорядоченное свертывание полипептидной цепи. Основным вариантом вторичной структуры является α-спираль, имеющая вид растянутой пружины. Она образована одной полипептидной цепью в результате возникновения внутримолекулярных водородных связей между карбоксильными группами и аминогруппами, расположенными на соседних витках спирали. Практически все СО- и NH-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость.
Третичная структура — это способ укладки полипептидных цепей в глобулы, возникающий в результате химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между боковыми цепями аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофобные взаимодействия, так как во многих белках приблизительно половина аминокислотных остатков имеет гидрофобные боковые цепи. Поэтому в водных растворах эти цепи стремятся спрятаться от воды, группируясь внутри, в то время как гидрофильные цепи в результате гидратации (взаимодействие с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. Третичная структура специфична для каждого белка.
Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя α-субъединицами (141 аминокислотный остаток) и двумя β-субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо.
Закрепление. Беседа. Работа учащихся с тетрадью и кодограммой.
Задание на дом. Изучить текст параграфа, ответить на вопросы.
Приложение 1. Кодограмма к уроку
Тема: Характеристика белков. § 3, до функций
Строение белков
10—20% от сырой массы и 50—80% от сухой массы клетки. Состоят из С, Н, О, N и S.
Макромолекулы (?), нерегулярные полимеры (?), мономеры — 20 видов α-аминокислот, из них 10 — незаменимые (?). В составе большинства белков — до 500 аминокислотных остатков. Полноценные белки содержат все 20 видов аминокислот. Неполноценные (?). Простые белки — только из аминокислот, сложные содержат небелковый компонент.
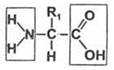
NH2 — аминогруппа;
R — радикал;
СООН — карбоксильная группа
При взаимодействии двух аминокислот происходит реакция конденсации и образуется азот-углеродная пептидная связь, дипептид.
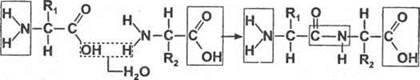
Первичная структура — число и последовательность аминокислот в полипептиде.
Вторичная структура: спираль, образована за счет водородных и ионных связей.
Третичная структура характерна для глобулярных белков. Ионные, водородные, ковалентные связи и гидрофильно-гидрофобное взаимодействие.
Четвертичная структура у белков, состоящих из нескольких полипептидов. Молекула гемоглобина состоит из 4 полипептидов — из 2 α-цепей (141 а.о.) и 2 β-цепей (146 а.о.), содержит 4 гема.
Приложение 2. Карточка для работы у доски
Запишите номера вопросов, против них — правильные ответы.
1. Какие моносахариды относятся к пентозам?
2. Какие моносахариды относятся к гексозам?
3. Какие дисахариды вам известны?
4. Напишите названия трех важнейших полисахаридов.
5. Какие свойства характерны для моно- и дисахаридов?
6. Какие мономеры входят в состав крахмала? Гликогена? Целлюлозы?
7. Запишите три важнейшие функции углеводов.
8. При полном сгорании 1 г вещества выделилось 38,9 кДж энергии. Какое вещество сгорело?
9. Какие вещества образуют основу клеточных мембран?
10. Какие функции выполняют липиды?
Записав ответ, садитесь на место.
Приложение 3. Компьютерное тестирование
Задание 2. «Углеводы, липиды»
**Тест 1. Какие из перечисленных веществ относятся к моносахаридам?
1. Крахмал.
2. Гликоген.
3. Глюкоза.
4. Дезоксирибоза.
5. Свекловичный сахар (сахароза).
6. Мальтоза.
7. Молочный сахар (лактоза).
8. Целлюлоза.
**Тест 2. Какие из перечисленных веществ относятся к полисахаридам?
1. Крахмал.
2. Гликоген.
3. Глюкоза.
4. Дезоксирибоза.
5. Хитин.
6. Мальтоза.
7. Молочный сахар (лактоза).
8. Целлюлоза.
**Тест 3. Какие из перечисленных веществ относятся к дисахаридам?
1. Крахмал.
2. Свекловичный сахар (сахароза).
3. Глюкоза.
4. Дезоксирибоза.
5. Хитин.
6. Мальтоза.
7. Молочный сахар (лактоза).
8. Целлюлоза.
Тест 4. Остатки какого моносахарида входят в состав молекулы ДНК?
1. Рибозы.
2. Дезоксирибозы.
3. Глюкозы.
4. Фруктозы.
Тест 5. Из остатков какого вещества состоит молекула крахмала?
1. Из остатков рибозы.
2. Из остатков α-глюкозы.
3. Из остатков и β-глюкозы.
4. Из остатков дезоксирибозы.
**Тест 6. Какие функции выполняют углеводы?
1. Структурную.
2. Энергетическую.
3. Каталитическую.
4. Многие являются гормонами.
5. Слизи выполняют защитную функцию.
6. Источник метаболической воды (образуется при окислении).
7. Запасающую.
Тест 7. При полном сгорании 1 г вещества выделилось 38,9 кДж энергии. Какое вещество сгорело?
1. Углеводы.
2. Жиры.
3. Или углеводы, или липиды. При их полном окислении выделяется 38,9 кДж энергии.
4. Не углеводы и не липиды. При их полном окислении выделяется 17,6 кДж энергии.
Тест 8. Какие вещества образуют основу клеточных мембран?
1. Жиры.
2. Фосфолипиды.
3. Воски.
4. Липиды.
Тест 9. Верно ли утверждение: «Фосфолипиды — сложные эфиры глицерина (глицерола) и жирных кислот».
1. Верно.
2. Ошибочно.
**Тест 10. Какие функции выполняют липиды?
1. Структурную.
2. Энергетическую.
3. Теплоизолирующую.
4. Некоторые являются гормонами.
5. Некоторые являются ферментами.
6. Источник метаболической воды (образуется при окислении).
7. Запасающую.
8. Витамины A, D, Е, К —- входят в состав некоторых ферментов.