Уроки Биологии в 10(11) классе развернутое планирование
БИОПОЛИМЕРЫ. СВОЙСТВА И ФУНКЦИИ БЕЛКОВ - ХИМИЧЕСКИЙ СОСТАВ КЛЕТКИ - КЛЕТКА — ЕДИНИЦА ЖИВОГО
Задачи. Сформировать знания о важнейших свойствах и функциях белков. Провести практическую работу по наблюдению расщепления пероксида водорода ферментом каталазой. Повторить материал и проконтролировать знания учащихся по теме «Строение белков».
Оборудование. Раздаточный материал: на каждый стол — штатив с тремя пробирками (в первой кусочек сырого мяса, во второй кусочек сырого картофеля, в третьей кусочек вареного картофеля); склянки с 3% раствором пероксида водорода, баночки с водой и элодеей, микроскопы, предметные, покровные стекла, пинцеты и пипетки. Демонстрационный материал: таблицы по общей биологии, отрезок гибкого провода длиной около 1 м, модель первичной структуры белка — разноцветные шарики-бусинки на нитке, кодограмма (приложение 1).
Ход урока:
Повторение. В связи с практической работой письменная работа с карточками в целях экономии времени не проводится.
Работа с карточкой у доски: приложение 2.
Компьютерное тестирование: приложение 3.
Устное повторение.
Изучение нового материала. Объяснение с помощью таблиц, кодограммы (приложение 1).
Свойства и функции белков. Изучение нового материала проводится в два этапа.
На первом этапе в ходе беседы учитель объясняет все функции белков. Объясняется значение каталазы в растительной и животной клетке: ее присутствие во всех клетках растений и животных, ее функции — расщепление опасного для клетки пероксида водорода до кислорода и воды. На втором этапе проводится практическая работа по обнаружению каталитической функции каталазы и явления денатурации.
Аминокислотный состав, структура белковой молекулы определяют его свойства. Белки являются амфотерными соединениями, сочетают в себе основные и кислотные свойства. Чем больше кислых аминокислот в белке, тем ярче выражены его кислотные свойства. Способность отдавать и присоединять Н+ определяют буферные свойства белков, один из самых мощных буферов — гемоглобин в эритроцитах, поддерживающий pH крови на постоянном уровне. Есть белки растворимые, есть нерастворимые белки, выполняющие механические функции (фиброин, кератин, коллаген). Есть белки необычайно активные (ферменты), есть химически неактивные, устойчивые к воздействию различных условий внешней среды и крайне неустойчивые.
Внешние факторы (изменение температуры, солевого состава среды, pH, радиация) могут вызывать нарушение структурной организации молекулы белка. Процесс утраты трехмерной конформации, присущей данной молекуле белка, называют денатурацией. Причиной денатурации является разрыв связей, стабилизирующих определенную структуру белка. Причем первоначально рвутся наиболее слабые связи, а при ужесточении условий и более сильные. Поэтому сначала утрачивается четвертичная, затем третичная и вторичная структуры. Вместе с тем денатурация не сопровождается разрушением полипептидной цепи. Изменение пространственной конфигурации приводит к изменению свойств белка и, как следствие, делает невозможным выполнение белком свойственных ему биологических функций. Денатурация может быть: обратимой, если возможно восстановление свойственной белку структуры. Такой денатурации подвергаются, например, рецепторные белки мембраны, процесс восстановления структуры белка после денатурации называется ренатурацией. Если восстановление пространственной конфигурации белка невозможно, то денатурация называется необратимой. Обычно это происходит при разрыве большого количества связей, например, при варке яиц. Благодаря сложности, разнообразию форм и состава белки играют важную роль в жизнедеятельности клетки и организма в целом. Функции их разнообразны.
Одна из важнейших — строительная. Белки участвуют в образовании клеточных и внеклеточных структур: входят в состав клеточных мембран, шерсти, волос, сухожилий, стенок сосудов и т.д.
Транспортная. Некоторые белки способны присоединять различные вещества и переносить их к различным тканям и органам тела, из одного места клетки в другое. Например, белок крови гемоглобин присоединяет кислород и транспортирует его от легких ко всем тканям и органам, а от них в легкие переносит углекислый газ; в состав клеточных мембран входят особые белки, обеспечивающие активный и строго избирательный перенос некоторых веществ и ионов из клетки во внешнюю среду и обратно.
Регуляторная. Большая группа белков организма принимает участие в регуляции процессов обмена веществ. Такими белками являются гормоны — биологически активные вещества, выделяющиеся в кровь железами внутренней секреции (гормоны гипофиза, поджелудочной железы). Например, гормон инсулин регулирует уровень сахара в крови путем повышения проницаемости клеточных мембран для глюкозы, способствует синтезу гликогена, увеличивает образование жиров из углеводов.
Защитная. В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки — антитела, способные связывать и обезвреживать их. Фибрин, образующийся из фибриногена, способствует остановке кровотечений.
Двигательная. Особые сократительные белки участвуют во всех видах движения клетки и организма: образовании псевдоподий, мерцании ресничек и биении жгутиков у простейших, сокращении мышц у многоклеточных животных, движении листьев у растений и др.
Весьма важна для жизни клетки сигнальная функция белков. В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды. Так происходит прием сигналов из внешней среды и передача команд в клетку.
Запасающая. Благодаря белкам в организме могут откладываться про запас некоторые вещества. Например, при распаде гемоглобина железо не выводится из организма, а сохраняется в нем, образуя комплекс с белком ферритином. К запасным белкам относятся белки яйца, белки молока.
Энергетическая. Белки являются одним из источников энергии в клетке. При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж. Сначала белки распадаются до аминокислот, а затем до конечных продуктов — воды, углекислого газа и аммиака. Однако в качестве источника энергии белки используются тогда, когда другие (углеводы и жиры) израсходованы.
Каталитическая. Одна из важнейших функций белков. В состав клеток входит большое количество веществ, химически мало активных. Тем не менее, все биохимические реакции протекают с огромной скоростью, благодаря участию в них биокатализаторов — ферментов — веществ белковой природы. Скорость ферментативных реакций в десятки тысяч (а иногда и в миллионы раз) выше скорости реакций, идущих с участием неорганических катализаторов. Например, пероксид водорода без катализаторов разлагается медленно: ![]() В присутствии солей железа (катализатора) эта реакция идет несколько быстрее. Фермент каталаза за 1 сек. расщепляет до 100 тыс. молекул Н2О2.
В присутствии солей железа (катализатора) эта реакция идет несколько быстрее. Фермент каталаза за 1 сек. расщепляет до 100 тыс. молекул Н2О2.
Несмотря на большое количество и разнообразие ферментов, все их по особенностям строения молекул можно разделить на две группы: простые белки и сложные белки. У сложных ферментов, помимо белковой части, имеется добавочная группа небелковой природы — кофактор, например, многие витамины. В молекуле однокомпонентного белка выделяют особую часть, представляющую собой уникальное сочетание нескольких аминокислотных остатков, располагающихся в определенной части белковой молекулы. Ее называют активным центром фермента, который взаимодействует с молекулой субстрата с образованием фермент-субстратного комплекса. Затем фермент-субстратный комплекс распадается на фермент и продукт (продукты) реакции.
Согласно гипотезе, выдвинутой в 1890 г. Э. Фишером, субстрат подходит к ферменту, как ключ к замку, то есть пространственные конфигурации активного центра фермента и субстрата точно соответствуют друг другу. Субстрат сравнивается с «ключом», который подходит к «замку» — ферменту.
В 1959 году Д. Кошланд выдвинул гипотезу, по которой пространственное соответствие структуры субстрата и активного центра фермента создается лишь в момент их взаимодействия друг с другом. Эту гипотезу называют гипотезой «руки и перчатки» (гипотезой индуцированного соответствия).
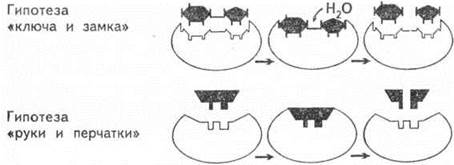
Соответствие фермента и субстрата
Поскольку все ферменты являются белками, их активность наиболее высока при физиологически нормальных условиях: большинство ферментов наиболее активно работает только при определенной температуре. При повышении температуры до некоторого значения (в среднем до 50 °С) каталитическая активность растет (на каждые 10 °С скорость реакции повышается примерно в 2 раза). При температуре выше 50 °С белок подвергается денатурации и активность фермента падает. Кроме того, для каждого фермента существует оптимальное значение pH, при котором он проявляет максимальную активность.
На скорость реакции влияет также концентрация субстрата и концентрация фермента. При увеличении количества субстрата скорость ферментативной реакции растет до тех пор, пока количество молекул субстрата не станет равным количеству молекул фермента. При дальнейшем увеличении количества субстрата скорость увеличиваться не будет, так как происходит насыщение активных центров фермента. Увеличение концентрации фермента приводит к усилению каталитической активности, так как в единицу времени преобразованиям подвергается большее количество молекул субстрата.
Закрепление. Работа учащихся с тетрадью и кодограммой. Выполнение практической работы и объяснение ее результатов.
Задание к практической работе.
1. Прилейте по 2 мл Н2О2 (пероксида водорода ) в пробирки с кусочком сырого мяса, с сырым и вареным картофелем. Объясните наблюдаемые вами явления при действии пероксида на живые и мертвые клетки (в пробирке с вареным картофелем).
2. На предметное стекло в каплю воды положите лист элодеи и рассмотрите под микроскопом на малом увеличении место отрыва листа от стебля.
3. Нанесите на лист элодеи две капли пероксида водорода, накройте покровным стеклом и под микроскопом рассмотрите место отрыва листа от стебля. Объясните бурное выделение пузырьков кислорода из поврежденных клеток листа элодеи.
Задание на дом. Изучить текст параграфа, ответить на вопросы.
Приложение 1. Кодограмма к уроку
Тема: Свойства и функции белков. §3
Свойства белков
У человека более 10 000 видов разных белков.
Свойства белков: 1. Денатурация (утрата трехмерной конформации без изменения первичной структуры). Ренатурация. 2. Нерастворимые белки (кератин, фиброин) и растворимые белки (альбумины, фибриноген). 3. Малоактивные и химически высокоактивные. 4. Устойчивые и крайне неустойчивые. 5. Фибриллярные и глобулярные. 6. Нейтральные (альбумины, глобулины); основные (гистоны), кислые (казеин). 7. Инактивация при замерзании.
Функции белков
1. Строительная (в мембранах). 2. Рецепторная (на гормоны, медиаторы). 3. Регуляторная (гормоны гипофиза, поджелудочной железы (?). 4. Белки-транспортеры (транспорт газов, гормонов...). 5. Белки — средства защиты организма (антитела, интерферон). б. Токсины (змеиный и др.). 7. Двигательная функция (актин. миозин). 8. Энергетическая функция ![]() 9. Запасающая (яичный альбумин). 10. Каталитическая: ферменты. Имеют активный центр. Фишер, 1890 г., гипотеза «ключа и замка» (ключ — субстрат, замок — фермент).
9. Запасающая (яичный альбумин). 10. Каталитическая: ферменты. Имеют активный центр. Фишер, 1890 г., гипотеза «ключа и замка» (ключ — субстрат, замок — фермент).
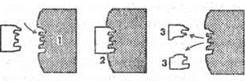
1 — активный центр фермента каталаза, 250 000;
2 — фермент-субстрастный комплекс;
3 — продукты реакции ![]()
Известно более 2000 ферментов. Каталаза при 0 °С разлагает в 1 сек. до 40 000 молекул пероксида водорода. Ферменты специфичны (?), их каталитическая активность зависит от t°, pH (?). Многим необходимы кофакторы (витамины).
Приложение 2. Карточка для работы у доски
Запишите номера вопросов, против них — правильные ответы.
1. Какие органические вещества в клетке на первом месте по массе?
2. Какие элементы входят в состав простых белков?
3. Сколько аминокислот образует все многообразие белков?
4. Сколько аминокислот являются незаменимыми для человека?
5. Какие белки называются неполноценными?
6. Какая функциональная группировка придает аминокислоте кислые, какая — щелочные свойства?
7. В результате какой реакции образуется пептидная связь?
8. Между какими группировками аминокислот образуется пептидная связь?
9. Какие связи стабилизируют вторичную структуру белков?
10. Какую структуру имеет молекула гемоглобина?
Записав ответы, садитесь на место.
Приложение 3. Компьютерное тестирование
Задание 3. «Строение белков»
Тест 1. Какие органические вещества в клетке на первом месте по массе?
1. Углеводы.
2. Белки.
3. Липиды.
4. Нуклеиновые кислоты.
**Тест 2. Какие элементы входят в состав простых белков?
1. Углерод.
2. Водород.
3. Кислород.
4. Сера.
5. Фосфор.
6. Азот.
7. Железо.
8. Хлор.
Тест 3. Сколько аминокислот образует все многообразие белков?
1. 170.
2. 26.
3. 20.
4. 10.
Тест 4. Сколько аминокислот являются незаменимыми для человека?
1. Таких аминокислот нет.
2. 20.
3. 10.
4. 7.
Тест 5. Какие белки называются неполноценными?
1. В которых отсутствуют некоторые аминокислоты.
2. В которых отсутствуют некоторые незаменимые аминокислоты.
3. В которых отсутствуют некоторые заменимые аминокислоты.
4. Все известные белки являются полноценными.
Тест 6. Какая функциональная группировка придает аминокислоте кислые, какая — щелочные свойства?
1. Кислые — радикал, щелочные — аминогруппа.
2. Кислые — аминогруппа, щелочные — радикал.
3. Кислые — карбоксильная группа, щелочные — радикал.
4. Кислые — карбоксильная группа, щелочные — аминогруппа.
Тест 7. В результате какой реакции образуется пептидная связь?
1. Реакция гидролиза.
2. Реакция гидратации.
3. Реакции конденсации.
4. Все вышеперечисленные реакции могут привести к образованию пептидной связи.
Тест 8. Между какими группировками аминокислот образуется пептидная связь?
1. Между карбоксильными группами соседних аминокислот.
2. Между аминогруппами соседних аминокислот.
3. Между аминогруппой одной аминокислоты и радикалом другой.
4. Между аминогруппой одной аминокислоты и карбоксильной группой другой.
Тест 9. Какие связи стабилизируют вторичную структуру белков?
1. Ковалентные.
2. Водородные.
3. Ионные.
4. Такие связи отсутствуют.
Тест 10. Какую структуру имеет молекула гемоглобина?
1. Первичную.
2. Вторичную.
3. Третичную.
4. Четвертичную.