Биология для выпускников школ и поступающих в вузы - Мустафин А. Г. 2015 год
ХИМИЯ ЖИЗНИ - ОБЩАЯ БИОЛОГИЯ
В состав клеток живых организмов входят те же химические элементы, что и в составе объектов неживой природы. Однако соотношение различных элементов в объектах живой и неживой природы неодинаково.
В клетках живых организмов на долю углерода, кислорода, азота и водорода приходится почти 98% массы. Относительное содержание этих элементов значительно выше, чем в земной коре. Они являются основными компонентами органических соединений. Их называют макроэлементами.
Жизненно необходимыми являются также восемь элементов, содержание которых в клетке исчисляется десятыми и сотыми долями процента и в сумме составляет менее 2%. Это магний, натрий, кальций, железо, калий, сера, фосфор, хлор. Сера и фосфор входят в состав молекул биополимеров. Натрий, калий и хлор участвуют в образовании разности зарядов внешней и внутренней поверхностей мембраны клетки, обусловливающей такие важные процессы, как возбуждение и проведение возбуждения по нерву или мышце. Железо является компонентом гемоглобина. Кальций и фосфор, накапливаясь в костной ткани, придают прочность костям. Магний входит в состав хлорофилла и многих ферментов.
К группе микроэлементов относят цинк, медь, йод, фтор, марганец, кобальт, кремний и другие элементы, содержащиеся в клетке в исключительно малых количествах (суммарное содержание порядка 0,1%). Несмотря на низкое содержание в живых организмах, микроэлементы играют чрезвычайно важную роль: они входят в состав различных ферментов, гормонов, витаминов и обусловливают тем самым нормальное развитие и функционирование структур клетки и организма в целом. Так, например, медь является составной частью ряда ферментов, занятых в процессах тканевого дыхания. Цинк - необходимый компонент почти 100 ферментов, в частности ДНК- и РНК-полимераз; он содержится также в гормоне поджелудочной железы — инсулине. Кобальт входит в состав витамина В]2, регулирующего кроветворную функцию. Йод является компонентом гормона щитовидной железы — тироксина. При недостатке этих элементов в почве, следовательно, в воде и пищевых продуктах снижается их содержание в организме. При этом развиваются различные патологические состояния (сахарный диабет, эндемический зоб, злокачественная анемия и др.). Химические элементы входят в состав молекул органических и неорганических веществ, формирующих состав тела организма.
Химические элементы входят в состав клеток в виде ионов или компонентов молекул неорганических и органических веществ.
Относительно простые химические соединения, которые встречаются как в живой, так и в неживой природе (в минералах, природных водах), называют неорганическими (минеральными) веществами (вода, минеральные соли). Многообразные соединения углерода, синтезируемые преимущественно живыми организмами, называют органическими веществами (углеводы, липиды, белки, нуклеиновые кислоты, витамины и др.).
Вода
Наличие воды является обязательным условием жизнедеятельности клетки. Вода — одно из самых распространенных веществ на Земле и преобладающий компонент всех живых организмов. Среднее содержание воды в клетках большинства организмов составляет около 70% (в клетках медузы — 96%). У человека содержание воды в клетках костной ткани составляет 20%, жировой ткани — 40%, мышечной ткани — 70%, в клетках головного мозга — до 85%, а в клетках развивающегося зародыша около 90%. Таким образом, количество воды в различных органах и тканях варьирует и зависит от уровня их обменных процессов. Вода в клетке находится в двух формах: свободной и связанной. Свободная вода составляет 95% всей воды клетки; на долю связанной воды, входящей в состав фибриллярных структур и соединенной с некоторыми белками, приходится около 5%.
Роль воды в клетке определяется ее химическими и физическими свойствами. Вода обладает рядом свойств, имеющих исключительно важное значение для живых организмов. Уникальные свойства воды определяются структурой ее молекул. Молекула воды является диполем. Атом кислорода в ней ковалентно связан с двумя атомами водорода. Положительные заряды сосредоточены у атома водорода, так как кислород электроотрицательнее водорода. Молекулы воды способны образовывать между собой водородные связи. По прочности водородная связь примерно в 20 раз слабее ковалентной, поэтому она легко разрывается, например, при испарении воды.
Малые размеры молекул воды, их полярность и способность соединяться между собой водородными связями обеспечивают хорошее растворение в воде многих минеральных и органических веществ, газов и др. Вещества, хорошо растворимые в воде, называют гидрофильными. К ним относят многие кристаллические соли, ряд органических веществ — спирты, сахара, некоторые белки (например альбумины, гистоны). Вещества, плохо или вовсе не растворимые в воде, называют гидрофобными. Последние представлены жирами, нуклеиновыми кислотами, некоторыми белками (глобулины, фибриллярные белки).
Вода обладает высокой удельной теплоемкостью и теплопроводностью. Высокая теплоемкость воды, т.е. способность поглощать теплоту при минимальном изменении собственной температуры, делает ее идеальной жидкостью для поддержания теплового равновесия клетки и организма. Так как на испарение воды расходуется много теплоты, то, испаряя воду, организмы могут защищать себя от перегрева (например, при потоотделении). Вода обладает высокой теплопроводностью, обеспечивая возможность равномерного распределения теплоты между тканями организма. В результате устраняется риск температурного повреждения клеток.
Вода является дисперсионной средой, играющем важную роль в коллоидной системе цитоплазмы. Она определяет структуру и функциональную активность многих макромолекул, служит основной средой для протекания химических реакций и непосредственным участником реакций синтеза и расщепления органических веществ. Вода обеспечивает транспорт веществ в клетке и организме (диффузия, кровообращение, восходящий и нисходящий ток растворов по телу растения и др.).
Вода практически не сжимается, создавая тургорное давление и определяя объем и упругость клеток и тканей. Клетки могут использовать воду в качестве источника кислорода и ионов водорода, выделяемых в световую фазу фотосинтеза.
Минеральные вещества
Неорганические соединения клетки чаше всего находятся в виде солей, диссоциированных в растворе на ионы. Также соли встречаются в твердом состоянии (карбонаты и фосфаты кальция костной ткани, известковые или кремневые панцири губок, раковин моллюсков, многих диатомовых и красных водорослей).
Неорганические ионы имеют большое значение для обеспечения процессов жизнедеятельности клетки. Наиболее важными для клеток являются катионы К+, Na+, Mg3+, Са2+ и анионы HPO42-, НРО4-, Cl-, НСО3- минеральных солей. Концентрация катионов и анионов в клетке и в окружающей ее среде различна. Внутри клетки превалируют ионы К+ и крупные органические ионы, в околоклеточных жидкостях всегда больше ионов Na+ и Сl-. Вследствие этого образуется разность зарядов внешней и внутренней поверхностей мембраны клетки, между ними возникает разность потенциалов, обусловливающая такие важные процессы, как передача возбуждения по нерву или мышце. Для нормального сокращения сердечной мышцы млекопитающих необходимо определенное соотношение К+, Na+ и Са2+. При нарушении баланса этих ионов работа сердечной мышцы нарушается. Снижение уровня Са2+ в крови вызывает судороги и смерть.
Содержащиеся в организме ионы имеют важное значение для поддержания постоянства реакций среды в клетке и в окружающих ее растворах. т.е. являются компонентами буферных систем. Буферы поддерживают слабощелочную реакцию содержимого клеток. Наиболее значимыми буферными системами млекопитающих являются фосфатная и бикарбонатная. Фосфатная буферная система состоит из НРО42- и Н2РО4- и поддерживает pH внутриклеточной жидкости в пределах 6,9—7,4. Главной буферной системой внеклеточной среды (плазмы крови) служит бикарбонатная система, состоящая из Н2СО3 и HCO3- и поддерживающая pH на уровне 7,4. Соединения азота, фосфора, кальция и другие неорганические вещества служат источником строительного материала для синтеза органических молекул (аминокислот, белков, нуклеиновых кислот и др.) и входят в состав ряда опорных структур клетки и организма. Соли кальция и фосфора входят в состав костной ткани животных. Некоторые неорганические ионы (например, ионы кальция и магния) являются активаторами и компонентами многих ферментов, гормонов и витаминов. При недостатке этих ионов нарушаются жизненно важные процессы в клетке. Соляная кислота входит в состав желудочного сока животных и человека, ускоряя процесс переваривания белков пиши Остатки серной кислоты, присоединяясь к нерастворимым в воде веществам, придают им растворимость, способствуя выведению из организма Натриевые и калиевые соли азотистой и фосфорной кислот, кальциевая соль серной кислоты служат важными компонентами минерального питания растений, их вносят в почву в качестве удобрений.
Органические вещества
Химическими признаками живого служат органические соединения. Они составляют около 20—30% массы клетки живого организма и чрезвычайно многообразны. Наибольшее значение в жизнедеятельности клеток имеют нуклеиновые кислоты (1—5%), белки (10—20%), липиды (5—10%) и углеводы (1—5%). Они являются структурными элементами клеток, а также их функциональными элементами, так как играют важную роль в процессах обмена веществ. Основу органических веществ составляют атомы углерода, способные вступать друг с другом в прочные ковалентные связи и образовывать разнообразные по форме каркасы органических молекул. В зависимости от молекулярной массы и структуры различают малые низкомолекулярные органические молекулы — мономеры и более крупные, высокомолекулярные макромолекулы — полимеры. Мономеры служат строительными блоками для полимеров. Полимеры представляют собой линейные или разветвленные цепи, содержащие большое число мономерных звеньев. Свойства биополимеров зависят от числа, состава и порядка расположения составляющих их мономеров. Возможность изменения состава и последовательности мономеров в структуре полимера лежит в основе образования значительного числа вариантов биологических макромолекул, обладающих различными свойствами. Этот принцип играет важную роль в понимании многообразия живых организмов.
Углеводы
Содержание углеводов в животных клетках составляет 1—5%, а в некоторых клетках растений достигает 70%. Углеводы состоят из углерода, водорода и кислорода. Как следует из названия, углеводы представляют собой соединения углерода и воды. Различают три основных класса углеводов: моносахариды, олигосахариды и полисахариды, различающиеся числом мономерных звеньев.
Формула моносахаридов — СnН2nОn. Это бесцветные, твердые кристаллические вещества, легко растворимые в воде, но нерастворимые в неполярных растворителях, имеющие, как правило, сладкий вкус. В зависимости от числа атомов углерода различают триозы, тетрозы, пентозы, гексозы и гептозы. Наиболее распространены в природе гексозы (глюкоза, фруктоза, галактоза) - основные источники энергии в клетках (при полном расщеплении 1 г глюкозы высвобождается 17,6 кДж энергии) и пентозы (рибоза, дезоксирибоза), входящие в состав нуклеотидов нуклеиновых кислот. В обмене веществ участвуют главным образом в форме фосфатов.
Два или несколько ковалентно связанных друг с другом с помощью гликозидной связи моносахарида образуют ди- или олигосахариды.
Дисахариды также широко распространены в природе: наиболее часто встречаются сахароза (сахар, получаемый из сахарного тростника или свеклы), состоящая из глюкозы и фруктозы; мальтоза (солодовый сахар), образована двумя молекулами глюкозы; лактоза (молочный сахар), входящая в состав молока и состоящая из галактозы и глюкозы. Дисахариды близки по своим свойствам к моносахаридам, хорошо растворимы в воде и имеют сладкий вкус.
Полисахариды - это биополимеры, содержа! большое число моносахаридных остатков, связанных гликозидной связью и обладают высокой молекулярной массой. Они утрачивают сладкий вкус и способность растворяться в воде. В составе организмов имеется много разнообразных полисахаридов. Наиболее широко распространены такие полимеры глюкозы, как крахмал (растения) и гликоген (животные), используемые клетками для запасания энергии, а также целлюлоза (растения) и хитин (грибы и животные), обеспечивающие прочность покровных структур В частности, в состав клеточной стенки клеток растений входит около 20—40% целлюлозы. Многие полисахариды животных образуют соединения с белками (гликопротеины) и липидами (гликолипиды). Птиколипиды участвуют в построении клеточных мембран. Гликопротеины (например, гепарин) регулируют свертывание крови, липидный обмен и др. Большинство мембранных и секретируемых клеткой белков относятся к гликопротеинам.
Углеводы являются мощным и богатым источником энергии, необходимой клетке для осуществления различных форм активное ги. При окислении 1 г углеводов выделяется 17,6 кДж энергии (для этой цели, как правило, используется глюкоза). Полисахариды — удобная форма накопления энергоемких моносахаридов (в виде крахмала у растений и гликогена у животных), а также незаменимый защитный и структурный компонент клеток и тканей животных, растений и микроорганизмов. Некоторые полисахариды входят в состав клеточных мембран и служат рецепторами, обеспечивая избирательные контакты клеток и их взаимодействие.
Липиды
Липиды — органические вещества, нерастворимые в воде, но хорошо растворимые в органических растворителях — эфире, хлороформе, бензоле. Они обнаружены во всех без исключения клетках и разделены на несколько классов, выполняющих специфические биологические функции. Количество липидов в разных клетках варьирует: от 2—3 до 50—90% в клетках семян растений и жировой ткани животных. Наиболее распространенными в составе живой природы являются нейтральные жиры, или триацилглицерины, воска, фосфолипиды, стеролы. По химической структуре жиры представляют собой соединения трехатомного спирта глицерина и высокомолекулярных жирных кислот. Воска — эфиры одноатомного спирта и жирных кислот. Фосфолипиды построены так же, как жиры, но отличаются от последних наличием остатка фосфорной кислоты. Сложные липиды представляют собой эфиры спирта, жирных кислот и других веществ (гликопротеиды состоят из белков и липидов, гликолипиды — из углеводов и липидов).
Жирные кислоты являются ценным источником энергии. При окислении 1 г липидов высвобождается 38,9 кДж энергии и синтезируется в 2 раза большее количество АТФ, чем при расщеплении такого же количества глюкозы. Нейтральные жиры накапливаются клетками для последующего использования в качестве источника энергии или пластического материала. У позвоночных животных примерно половина энергии, потребляемой клетками в состоянии покоя, образуется за счет окисления жиров. Жиры используются также в качестве источника воды (при окислении 100 г жира образуется более 100 мл воды). Это особенно ценно для арктических и пустынных животных, обитающих в условиях дефицита свободной воды. У многих млекопитающих под кожей откладывается толстый слой подкожного жира, который благодаря низкой теплопроводности защищает организм от переохлаждения. Листья и плоды многих растений покрыты защитным восковым налетом. Воска вырабатываются и используются в очень больших количествах морскими организмами, особенно планктонными. У позвоночных животных воска секретируются кожными железами. Покрывая кожу и ее производные (волосы, шерсть, мех, перья), воска смягчают их и предохраняют от действия воды. Фосфолипиды являются основой клеточных мембран. Стероиды составляют группу липидов, не содержащих жирных кислот и имеющих особую структуру. К ним относится ряд гормонов, в частности кортизон, вырабатываемый корой надпочечников, различные половые гормоны, а также холестерин — важный компонент клеточных мембран у животных.
Белки
Белки — это биологические непериодические гетерополимеры, мономерами которых являются аминокислоты. Молекулы белков представляют собой неветвящиеся структуры (линейные макромолекулы). Аминокислоты чередуются в молекуле полимера нерегулярным образом. Белки представляют собой самый многочисленный и наиболее разнообразный класс органических соединений клетки (10—20%).
Аминокислоты — мономеры, входящие в состав полипептидов имеют как минимум одну аминогруппу (-NH2) и карбоксильную группу (-СООН) и различаются структурой и физико-химическими свойствами радикалов (R). В состав природных белков может входить до 20 разновидностей аминокислот. Восемь аминокислот являются незаменимыми, т.е. клетками человека не синтезируются и должны поступать с пищей. Наличие карбоксильной и аминогруппы в составе аминокислот (совмещение свойств кислоты и основания) позволяет им вступать во взаимодействие друг с другом с образованием прочных ковалентных пептидных связей (рис. 3.1). Рост полипептидной цепи происходит с N конца в рибосоме.
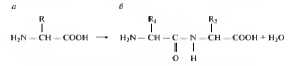
Рис. 3.1. Наличие карбоксильной и аминогруппы в составе аминокислот (а) позволяет им вступать во взаимодействие друг с другом с образованием ковалентных пептидных связей (б).
Аминокислоты, соединяясь друг с другом, образуют различной длины пептиды. Пептиды, содержащие от нескольких аминокислотных остатков до нескольких десятков, существуют в организме в свободной форме и обладают высокой биологической активностью. К ним относят ряд гормонов (окситоцин, адренокортикотропный гормон), некоторые очень токсичные ядовитые вещества (например, аманитин грибов), а также многие антибиотики, производимые микроорганизмами.
Число аминокислотных остатков в белковых молекулах варьирует в широких пределах (от нескольких сотен до нескольких тысяч). Среди белков организма выделяют простые белки (протеины), состоящие только из аминокислот, и сложные (протеиды), включающие помимо аминокислот так называемые простетические группы различной химической природы (играют важную роль при выполнении белком его биологической функции.
Липопротеины имеют в своем составе липидный компонент:
• гликопротеины — углеводный;
• фосфопротеины имеют одну или несколько фосфатных групп;
• металлопротеины содержат различные металлы:
• нуклеопротеины — нуклеиновые кислоты.
Первичная структура белковой молекулы представлена последовательностью аминокислотных остатков в составе полипептидной цепи. Порядок расположения аминокислот закодирован последовательностью нуклеотидов участка молекулы ДНК. Белки отличаются друг от друга прежде всего числом, составом и последовательностью аминокислотных остатков. Первичная структура любого белка определяет его форму, свойства и функции. Молекулы белков способны образовывать определенную трехмерную пространственную конфигурацию (конформация белковой молекулы). Различают вторичную, третичную и четвертичную структуры белковой молекулы (рис. 3.2).
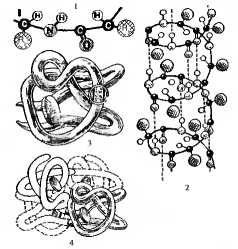
Рис. 3.2. Уровни структурной организации белка:
1 — первичная структура белка, 2— вторичная структура (спираль), 3 — третичная структура, 4 — четвертичная структура.
Вторичная структура возникает в результате образования водородных связей между —СО— и NH— группами разных аминокислотных остатков полипептидной цепи и может быть в виде правильной правозакрученной альфа-спирали (глобин) или складчатой (бета-) структуры (кератин волос).
Третичная структура образуется в результате сложной пространственной укладки молекулы белка. Прочность третичной структуры обеспечивается разнообразными связями, возникающими между радикалами аминокислот (дисульфидными, ионными, гидрофобными). Формирование третичной структуры осуществляется в несколько стадий с участием особых белков, присоединяющих к себе поли пептидную цепочку и создающих условия для укладки ее в трехмерную структуру. Белки могут иметь глобулярную структуру (глобин) или фибриллярную (миозин) структуру. Биологические функции многие белки выполняют на уровне третичной структуры.
Некоторые белки имеют четвертичную структуру, которая представляет собой сложный комплекс, объединяющий несколько третичных структур (например, белок гемоглобин образован четырьмя глобулами), удерживающихся нековалентными ионными, водородными и гидрофобными связями. Нарушение природной структуры белка, следовательно, свойств и биологической активности называют денатурацией. Денатурация может быть обратимой и необратимой. В первом случае нарушается четвертичная, третичная или вторичная структуры и возможен обратный процесс восстановления конформации — ренатурация, во втором — происходит разрыв пептидных связей в составе первичной структуры. Денатурация вызывается химическими воздействиями, высокой температурой, облучением, высоким давлением и т.д. Изменение конформации белковой молекулы лежит в основе ряда функций клеток (рецепторные, антигенные и др.).
Функции белков чрезвычайно разнообразны. Они основаны на сложности и многообразии форм и состава самих белков.
Ферментная, или каталитическая. Ферменты увеличивают скорость биохимических реакций в десятки и сотни миллионов раз. Ферменты высокоспецифичны: каждый фермент катализирует определенный тип реакций, в которых участвуют определенные виды молекул субстратов. Специфичность фермента определяется особенностями структуры его активного центра, строго соответствующего структуре одного или нескольких субстратов. В ходе реакции фермент связывает субстрат, последовательно изменяет его конфигурацию, образуя ряд промежуточных молекул, дающих в конечном итоге продукты реакции. Активность фермента зависит от ряда факторов: температуры и реакции среды, наличия или отсутствия ряда веществ (например, витаминов, служащих коферментами).
Структурная. Белки являются компонентами клеточных мембран и многих органелл, главным компонентом опорных структур организма (кератин, коллаген).
Сократительная. Тубулины, актины, миозины обеспечивают движение клеток и внутриклеточных структур.
Транспортная. На клеточном уровне белки-переносчики обеспечивают поступление в клетку различных веществ. Гемоглобин в организме переносит кислород, сывороточный альбумин — жирные кислоты и др.
Защитная. Антитела, вырабатываемые лимфоцитами, блокируют антигены, предохраняя организм. Фибриноген и тромбин защищают организм от кровопотери.
Рецепторная. Особые клеточные белки способны специфически реагировать с различными агентами (гормоны и др.).
Регуляторная. Инсулин, гормон роста и другие ферменты участвуют в регуляции активности клеток и организма в целом
Пищевая. Белки эндосперма семян, яйцеклеток животных, казеин молока и др. используются в качестве питательного материала.
Энергетическая — при окислении 1 г белка освобождается 17,6 кДж энергии.
Нуклеиновые кислоты
Нуклеиновые кислоты были обнаружены в 1869 г. швейцарским химиком Мишнером в ядрах лейкоцитов, чем и обусловлено их название (от лат. nucleus — ядро). Модель строения ДН К предложили Дж. Уотсон и Ф. Крик в 1953 г. Различают два вида нуклеиновых кислот — дезоксирибонуклеиновые (ДНК) и рибонуклеиновые (РНК). Они выполняют исключительно важные функции, обеспечивая хранение, передачу и реализацию генетической информации в клетках. Нуклеиновые кислоты — непериодические линейные гетерополимеры, состоящие из мононуклеотидов.
Каждый нуклеотид состоит из одного пуринового (аденин — А, гуанин — Г) или пиримидинового (цитозин — Ц, тимин — Т, урацил — У) азотистого основания, сахара с пятью углеродными атомами (пентозы - дезоксирибозы или рибозы) и 1—3 остатков фосфорной кислоты. Каждое пуриновое или пиримидиновое основание связано с атомом 1-С пентозы, образуя нуклеозид. В молекуле нуклеотида атом 5-С пентозы нуклеозида связан эфирной связью с фосфатом (рис. 3.3). В зависимости от числа фосфатных групп различают моно-, ди- и трифосфаты нуклеотидов, например аденозинмонофосфат — АМФ, гуанозиидифосфат — ГДФ, уридинтрифосфат — УТФ, тимидинтрифосфат — ТТФ и т.д. Нуклеотиды принимают участие во множестве биохимических процессов клеток. Они выступают в качестве источников энергии (АТФ, ГТФ), регуляторных сигналов (цАМФ, цГМФ), входят в состав коферментов (ФАД, НАД, НАДФ) и др. Рибо- и дезоксирибомононуклеотиды являются предшественниками при биосинтезе полинуклеотидов РНК и ДНК.
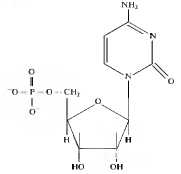
Рис. 3.3. Схема строения нуклеотида
РНК. Рибонуклеиновые кислоты представляют собой полимеры, содержащие от 70—80 до нескольких сотен тысяч рибомононуклеотидов, которые соединяются ковалентными 3-5-фосфодиэфирными связями, возникающими между гидроксильной группой рибозы одного нуклеотида и фосфатной группой следующего нуклеотида. Образующиеся полинуклеоткидные цепи представляют собой сахарофосфатный остов, на котором “сидит” четыре вида азотистых оснований. ДНК и РНК как два вида нуклеиновых кислот имеют много общего, но по ряду признаков они отличаются друг от друга.
Компоненты нуклеотидов РНК несколько иные, нежели в ДНК. В РНК углеводным остатком, к которому присоединяются азотистое основание и фосфатная группа, является рибоза, а не дезоксирибоза, как у ДНК. Набор азотистых оснований, входящих в состав РНК, также отличается. Вместо тимина в нуклеотидах PHК стоит другое пиримидиновое основание — урацил. Остальные азотистые основания те же, что и в ДНК — аденин, гуанин и цитозин. В отличие от ДНК молекула PHК состоит только из одной полинуклеотидной цепи. Длина молекулы РНК меньше, чем молекулы ДНК. Рибонуклеиновые кислоты (РНК) представлены разнообразными по размерам, структуре и выполняемым функциям молекулами. Все молекулы PHК являются копиями определенных участков молекул ДНК и в большинстве своем синтезируются в ядре. Почти все они непосредственно вовлечены в процесс биосинтеза белка, который в основном осуществляется в цитоплазме эукариотических клеток. Молекулы цитоплазматической РНК, выполняющие функции матриц белкового синтеза, называют матричными, или информационными, РНК (иРНК). Роль структурных компонентов рибосом выполняют рибосомные РНК (рРНК). Трансляцию (перевод) последовательности азотистых оснований иРНК в последовательность аминокислот в белках обеспечивают адапторные молекулы транспортных РНК (тРНК, рис. 3.4)
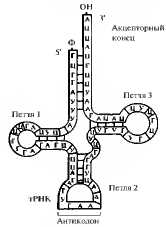
Рис. 3.4. Структура PHК
ДНК — генетический материал клеток — представляет собой двухцепочечную спирально закрученную молекулу.
Соединенные друг за другом в варьирующем порядке нуклеотиды образуют полинуклеотидную цепь - первичную структуру ДНК. Нуклеотиды соединяются ковалентными фосфодиэфирными связями, возникающими между гидроксильной группой у атома 3-С пентозы одного нуклеотида и фосфатной группой у атома 5-С пентозы следующего нуклеотида. Осевой скелет такой молекулы состоит из чередующихся остатков фосфатов и пентоз, тогда как азотистые основания присоединены сбоку. Таким образом, цепь полярна, она имеет 5-конец (фосфатный) и 3-конец (гидроксильный) (рис. 3.5). Полинуклеотидная последовательность цепи ДНК состоит из чередования информативных и неинформативных участков (экзонов и нитронов). Последовательность нуклеотидов или азотистых оснований нуклеотидов (первичная структура) ДНК в информативных участках представляет собой материальный эквивалент генетической информации. Она закодирована специфической последовательностью из четырех оснований — А, Г, Т и Ц подобно тому, как письменные сообщения кодируются буквами алфавита. Функция неинформативных участков (интронов) ДНК точно не установлена. Полагают, что они служат для физического разделения информативных участков с целью оптимизации процесса генетических рекомбинаций, могут участвовать в структурировании хроматина, позволяя участкам генетического материала упаковываться определенным образом. Другая часть некодирующей ДНК является регуляторной, обеспечивающей активность генов.
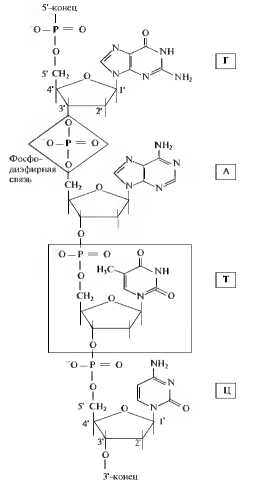
Рис. 3.5. Первичная структура ДНК
Вторичная структура ДНК представлена двойной спиралью, состоящей из двух поли нуклеотидных цепей, антипараллельно направленных и ориентированных таким образом, что их сахарофосфатные остовы оказываются снаружи, а азотистые основания — внутри. Основания располагаются парами друг против друга и соединяются водородными связями. Спаривание происходит только между комплементарными (подходящими друг другу) основаниями: одним пуриновым и одним пиримидиновым. Пара А—Т соединяется двумя, а Г—Ц — тремя водородными связями. Таким образом, благодаря специфическому спариванию оснований последовательность нуклеотидов н одной цепочке является как бы зеркальным отражением последовательности в другой. Спираль ДНК характеризуется рядом параметров Ширина спирали около 2 нм. Шаг или полный оборот спирали составляет 3,4 нм и содержит десять пар комплементарных нуклеотидов (рис. 3.6).
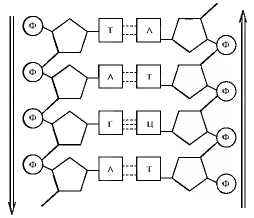
Рис. 3.6. Вторичная структура ДНК
Функции ДНК. Реализация наследственной информации
Дезоксирибонуклеиновая кислота практически у всех организмов (исключение составляют древние РНК-содержащие вирусы) является первичным носителем наследственной информации. Генетическая информация, закодированная в последовательности нуклеотидов, служит двум целям:
1) ДНК, обладая способностью к самоудвоению (репликации) и способностью к восстановлению (репарации), обеспечивает передачу информации в ряду клеточных поколений и поколений организмов;
2) ДНК необходима для синтеза белковых молекул в клетках
Генетическая информация (последовательность нуклеотидов ДНК) необходима для развития организма в определенных условиях среды, а также для воспроизведения себе подобных. Прокариоты и многие вирусы содержат генетическую информацию в виде одной молекулы ДНК, все участки полинуклеотидной последовательности которой кодируют макромолекулы. В эукариотических клетках генетический материал распределен в нескольких хромосомах. Хромосома содержит молекулу ДНК, полинуклеотидная последовательность которой состоит из участков, кодирующих и не кодирующих РНК и белки.
Единицей наследственной информации является ген. Ген — часть молекулы ДНК (хромосомы), кодирующей синтез одной макромолекулы: полипептида, рРНК либо тРНК. Гены находятся в локусах хромосом. Набор генов диплоидного организма представляет собой генотип. Он образуется в результате оплодотворения и содержит два генома (геном совокупность генов гаплоидного набора хромосом) родителей.
Функциональные возможности генетической информации.
• способность сохраняться и воспроизводиться при смене клеточных поколений;
• обеспечивать в процессе индивидуального развития формирование организма;
• в ряде случаев обеспечивать возникновение новых адаптаций организма к изменившимся условиям среды обитания связаны с протеканием следующих генетических процессов — репликации ДНК, мутаций ДНК, рекомбинаций ДНК, репарации ДНК (исправление нарушенной структуры), транскрипции ДНК.
Репликация ДНК
В процессе репликации ДНК происходит синтез двух дочерних молекул ДНК на основе информации цепей материнской молекулы ДНК. Репликация происходит перед делением клеток и размножением ДНК-вирусов. Репликация Д НК является необходимой предпосылкой для сохранения имеющейся наследственной информации в ряду последовательных поколений клеток и организмов. Образование молекул ДНК, а также РНК и белков происходит по типу матричного синтеза, т.е. новые молекулы синтезируются в точном соответствии с химической структурой уже существующих молекул (матриц).
Во время репликации ДНК каждая из двух ее цепей служит матрицей для образования новой цепи (рис. 3.7). Репликация начинается с раскручивания двойной спирали и разделения ее цепей за счет ферментативного разрыва водородных связей между спаренными основаниями. Затем фермент ДНК-полимераза движется вдоль каждой из цепей материнской ДНК, связывая между собой нуклеотиды, комплементарные нуклеотидам материнских цепей ДНК. В результате образуются две дочерние молекулы ДНК, идентичные молекуле материнской ДНК. Таким образом, осуществляется передача наследственной информации при делении клеток.
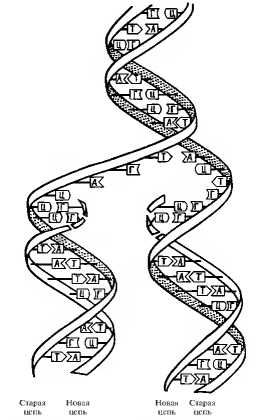
Рис. 3.7. Репликация ДНК Водородные связи, соединяющие комплементарные основания двойной спирали ДНК, последовательно разрушаются. Каждая из старых цепей служит матрицей для образования новой цепи при помощи ДНК-полимеразы дезоксирибонуклеозидтрифосфаты выстраиваются с комплементарными азотистыми основаниями против старой цепи и соединяются друг с другом ковалентными связями (между дезоксирибозой одного нуклеотида и фосфорной кислотой соседнего — фосфодиэфирная связь)
Реализация наследственной информации
Индивидуальное развитие организма происходит на основе генетической программы развития, полученной от родителей. Генетическая информация ДНК через различные виды РНК обеспечивает синтез в клетках разнообразных белков, которые управляют метаболизмом клеток и обеспечивают их дифференцировку и специализацию, формирование тканей и органов развивающегося организма. Перенос генетической информации в клетках от ДНК к РНК, а затем к полипептидам и белкам называют экспрессией (проявлением) генов.
Транскрипцией ДНК называют синтез всех видов РНК по матрице одной (кодогенной) цепи того или иного полинуклеотидного участка молекулы ДНК (рис. 3.8). Транскрипция начинается после присоединения фермента РНК-полимеразы к промотору (нуклеотидной последовательности ДНК, находящейся в начале гена). РНК-полимераза раскручивает примерно один виток спирали ДНК, водородные связи между спаренными нуклеотидами разрушаются и фермент движется по матричной (кодогенной) цепи ДНК, связывая между собой рибомононуклеотиды, комплементарные нуклеотидам цепи ДНК. Фермент продолжает присоединять нуклеотиды к растущей цепи РНК до тех пор, пока не встретит на своем пути еще одну специфическую нуклеотидную последовательность в цепи ДНК-герминатор. РНК-полимераза отсоединяется от цепи ДНК, и синтезировавшийся РНК-транскрипт отходит от ДНК. Таким образом, PHК молекулы являются копиями одной цепи не всей молекулы ДНК, а только части ее, одного гена или небольшой группы расположенных рядом генов. Затем участки РНК, комплементарные интронам, удаляются, а участки, комплементарные экзонам, сшиваются и PHК транспортируются в цитоплазму к месту синтеза полипептидов.
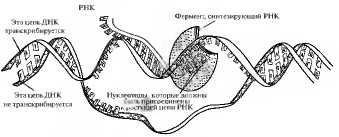
Рис. 3.8. Транскрипция (синтез РНК на ДНК-матрице). Часть двойной ДНК локально раскручивается, и вдоль одной из ее цепей движется фермент РНК-полимераза, который связывает между собой рибонуклеозидтрифосфаты, комплементарные нуклеотидам матричной (кодогенной) цепи ДНК
Трансляция иРНК. Синтез белка в клетке
Процесс синтеза полипептида по матрице иРНК в рибосоме называют трансляцией. Различные типы PHК взаимодействуют в процессе трансляции, в результате чего последовательность аминокислотных остатков в полипептиде будет соответствовать последовательности нуклеотидов иРНК, а следовательно, и ДНК.
Генетический код — принцип записи генетической информации о последовательности аминокислот в полипептиде в виде последовательности нуклеотидов в молекулах PHК и ДНК. Генетический код характеризуют следующие свойства:
• триплетность. В ДНК или РНК имеется четыре вида нуклеотидов. В состав белковых молекул входит 20 аминокислот. Чтобы закодировать аминокислоты, необходимы разные комбинации по три четырех видов нуклеотидов (43 = 64). Кодовый знак называю! триплетом (три последовательно соединенных нуклеотида цепи ДНК или РНК). Всего в генетическом коде возможны 64 триплета. Виды триплетов иРНК показаны в табл. 3.1: 61 триплет кодирует аминокислоты, эти триплеты называют кодонами иРНК, а комплементарные им триплеты молекул тРНК антикодонами; 3 триплета не кодируют аминокислоты: УАА, УАГ, УГА. Это стоп-сигналы, когда они попадают в рибосому, прекращается синтез полипептидной цепи,
• вырожденность. Аминокислоты (кроме метионина и триптофана) кодируются несколькими триплетами. Благодаря этому замена нуклеотидов в ДНК может в ряде случаев не привести к замене аминокислоты в полипептиде, и, несмотря на мутацию, свойства белка не изменятся;
• неперекрываемость. АУГ является стартовым кодоном: с него начинается трансляция. Он задает рамку считывания. Нуклеотидная последовательность считывается в одном направлении подряд — триплет за триплетом. Кодоны не перекрываются;
• генетический код универсален, он един для всех клеток и вирусов.
Таблица 3.1
Кодоны иРНК
|
Первое |
Второе основание |
Третье основание |
|||
|
У |
Ц |
А |
Г |
||
|
У |
УУУ Фен |
УЦУ Сер |
УАУ Тир |
УГУ Цис |
У |
|
УУЦ Фен |
УЦЦ Сер |
УАЦ Тир |
УГЦ Цис |
Ц |
|
|
УУА Лей |
УЦА Сер |
УАА Стоп |
УГА Стоп |
А |
|
|
УУГ Лей |
УЦГ Сер |
УАГ Стоп |
УГГ Три |
Г |
|
|
Ц |
ЦУУ Лей |
ЦЦУ Про |
ЦАУ Гис |
ЦГУ Арг |
У |
|
ЦУЦ Лей |
ЦЦЦ Про |
ЦАЦ Гис |
ЦГЦ Арг |
Ц |
|
|
ЦУА Лей |
ЦЦА Про |
ЦAA Глн |
ЦГА Арг |
А |
|
|
ЦУГ Лей |
ЦЦГ Про |
ЦАГ Глн |
ЦГГ Арг |
Г |
|
|
А |
АУУ Иле |
АЦУ Тре |
ААУ Асн |
АГУ Сер |
У |
|
АУЦ Иле |
АЦЦ Тре |
ААЦ Асн |
АГЦ Сер |
Ц |
|
|
АУА Иле |
АЦА Тре |
ААА Лиз |
АГА Apr |
А |
|
|
АУГ Мет |
АЦГ Тре |
ААГ Лиз |
АГГ Арг |
Г |
|
|
Г |
ГУУ Вал |
ГЦУ Ала |
ГАУ Асп |
ГГУ Гли |
У |
|
ГУЦ Вал |
ГЦЦ Ала |
ГАЦ Асп |
ГГЦ Гли |
Ц |
|
|
ГУА Вал |
ГЦА Ала |
ГAA Глу |
ГГА Гли |
А |
|
|
ГУГ Вал |
ГЦГ Ала |
ГАГ Глу |
ГГГ Гли |
Г |
|
Примечание. Первое азотистое основание в триплете находится в левом вертикальном ряду, второе — в верхнем горизонтальном, третье — в правом вертикальном. На пересечении линий трех оснований выявляется искомая аминокислота.
Аминокислоты обозначены следующим образом Ала — аланин, Apг — аргинин, Асн — аспарагин, Асп — аспарагиновая кислота. Вал — валин, Гис — гистидин, Гли — глииин, Глн — глутамин, Глу — глутаминовая кислота, Иле — изолейцин, Лей — лейцин, Лиз — лизин, Мет — метионин, Про — пролин, Сер — серин, Тир — тирозин, Тре — треонин, Три — триптофан, Фен — фенилаланин, Цис — цистеин.
Аминокислоты, из которых синтезируются полипептиды, доставляются в рибосомы с помощью транспортных РНК (см. рис. 3.4). В клетках существуют специальные ферменты, при помощи которых аминокислоты присоединяются к соответствующим молекулам тРНК. Это является необходимой предпосылкой безошибочного хода биосинтеза белков, так как молекулы тРНК играют роль посредника и находят с помощью своих антикодонов соответствующие кодоны мРНК по принципу спаривания оснований.
Для начала синтеза полипептида малая субъединица рибосомы должна соединиться с иРНК, а затем с тРНК, несущей аминокислоту — метионин. Антикодон этой тРНК (УАЦ) на основе принципа комплементарности присоединяется к стартовому кодону АУГ мРНК. Затем происходит соединение большой и малой субъединиц и формируется функциональная рибосома. Молекула тРНК и связанный с ней метионин оказываются в пептидильном участке рибосомы. В аминоацильном участке рибосомы находится следующий кодон и PHК. К нему присоединяется комплементарный антикодон тРНК, несущий вторую аминокислоту. Фермент присоединяет карбоксильную группу одной аминокислоты к аминогруппе другой аминокислоты. Рибосома перемещается вдоль иРНК, что сопровождается многократным повторением цикла присоединения очередной аминокислоты к растущей полипептидной цепи. В результате чего последовательность нуклеотидов в и PHК определяет последовательность аминокислот в полипептиде (рис. 3.9). Образование пептидных связей прекращается, когда рибосома достигает одного из трех стоп-кодонов. Особый белковый фактор освобождения связывается со стоп-кодоном, попавшим в аминоацильный участок рибосомы. Вследствие этого полипептидная цепь покидает рибосому и поступает в цитоплазму. Далее происходит образование определенной пространственной конфигурации и синтезированный белок способен выполнять свою функцию в клетке.
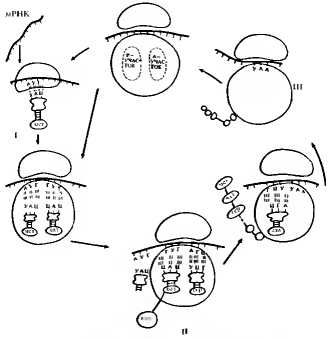
Рис. 3.9. Последовательные этапы синтеза полипептида:
I — малая субъединица рибосомы соединяется с инициаторной мет-тРНК, а затем с мРНК, после чего происходит образование целой рибосомы, состоящей из малой и большой субъединиц, II — рибосома перемещается вдоль мРНК, что сопровождается многократным повторением цикла присоединения очередной аминокислоты к растущей полипептидной цепи, III — рибосома достигает одного из трех стоп-кодонов мРНК, полипептидная цепь высвобождается и отделяется от рибосомы. Рибосомные субъединицы диссоциируют, отделяются от мРНК и могут принять участие в синтезе следующей полипептидной цепи
Тело многоклеточного организма построено из разнообразных клеточных типов. Различия между типами клеток обусловлены главным образом потому, что в дополнение к белкам, необходимым любой клетке организма, клетки каждого типа синтезируют свой набор специализированных белков: в эпидермисе образуется кератин, в эритроцитах — гемоглобин и т.д. Это приводит к появлению клеток со специфическими для них структурами и особыми функциями, т.е. к дифференцировке. Контроль активности генов осуществляют регуляторные белки: репрессоры и активаторы. Они присоединяются к специфическим нуклеотидным последовательностям ДНК, что способствует или препятствует транскрипции генов. Регуляторные белки в свою очередь служат посредниками между средой и ДНК клетки. Некоторые вещества (гормоны, факторы роста), проникающие в клетки, могут связываться с регуляторными белками и менять пространственную структуру этих молекул. Это либо повышает, либо понижает их сродство к ДНК и таким путем либо включает либо выключает транскрипцию генов. Специфический для каждой клетки набор активных генов постепенно формируется в процессе индивидуального развития многоклеточного организма. Характер генной экспрессии (транскрипции и трансляции определенных генов) передается клетками из поколения в поколение и обусловливает возникновение значительно отличающихся друг от друга клеточных типов одного организма, хотя геномы этих клеток идентичны геному зиготы.