Настольная книга учителя химии 10 класс - поурочные разработки
ХИМИЧЕСКИЕ СВОЙСТВА И ПРИМЕНЕНИЕ ПРЕДЕЛЬНЫХ УГЛЕВОДОРОДОВ - УГЛЕВОДОРОДЫ
Цели урока. Рассмотреть химические свойства алканов: реакции замещения, отщепления, окисления и разрыва цепи, — в плане развития полученных ранее первоначальных теоретических представлений. Раскрыть важнейшие области практического применения алканов.
Оборудование: парафин, гранулы Al2O3 (или кусочки неглазурованного фарфора, пемзы), бромная вода, пробирки, пробка с газоотводной трубкой, кристаллизатор. Демонстрационные образцы: газовая зажигалка с прозрачным резервуаром, бензин (авиационный или для зажигалок), вазелин, парафиновая свеча, фантики от конфет (парафиновая бумага), модели молекул Стюарта — Бриглеба.
I. Химические свойства алканов
Учитель может начать объяснение материала с одного из главных свойств алканов — реакции горения.
Человек постоянно находится в окружении многочисленных химических реакций, протекающих вокруг него и в нем самом. Порой мы просто не обращаем внимания на эти химические явления. Когда мы зажигаем на кухне газ или щелкаем зажигалкой, едем в автомобиле или смотрим по телевизору трагические последствия взрыва в шахте, мы свидетели реакции горения алканов. Как и большинство органических веществ, предельные углеводороды при горении образуют водяные пары и углекислый газ.
![]()
Если не было возможности продемонстрировать горение метана или парафиновой свечи и обнаружить продукты сгорания, можно провести эти опыты на данном уроке.
Учитель просит ребят вспомнить, как классифицируются реакции по тепловому эффекту. Что такое экзотермическая реакция? Эндотермическая? Учащиеся без труда определяют, что горение метана — экзотермический процесс. Будет верным, если ученики среди экзотермических реакций выделят и такую их разновидность, как реакции горения, которые протекают не только с выделением теплоты, но и света. Учитель дописывает в уравнение тепловой эффект реакции (880 кДж/моль), спрашивает, как называются такие уравнения (термохимические). При горении предельных углеводородов выделяется большое количество теплоты, что предопределяет их использование в качестве топлива.
Важно подчеркнуть, что строение молекулы вещества во многом определяет его химические свойства. Это очень важное положение впервые высказано автором теории химического строения А. М. Бутлеровым. Учитель предлагает ребятам вспомнить строение молекулы метана. Атомы углерода и водорода полностью исчерпали свои валентные возможности. Каким же образом можно из метана получить другое вещество? Для этого нужно разорвать связь С—Н и заменить водород другим атомом или группой атомов. Таким образом, для алканов характерны реакции замещения. Какие существуют типы разрыва химической связи? Гомолитический и гетеролитический. Если разрыв связи С—Н происходит по гемолитическому механизму, т. е. через образование радикалов, то это реакции радикального замещения. Схема такой реакции выглядит очень просто:
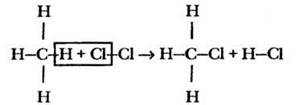
При достаточном количестве галогена реакция продолжается до образования полизамещенных продуктов: дихлорметана (СН2Сl2), трихлорметана (CHCl3), тетрахлорметана (ССl4). В качестве галогена в таких реакциях можно использовать только хлор и бром. Реакция с фтором протекает со взрывом и приводит к разрушению молекулы алкана, а йод, как менее активный галоген, к такому превращению не способен.
Химику, в отличие, например, от технолога, недостаточно знать, какие продукты получатся из исходных веществ. Ему важно иметь представление, как происходит превращение (это и называется механизмом реакции). Взаимодействие метана с хлором протекает только при сильном нагревании. Какую роль играет электромагнитное излучение в этой реакции?
Учитель отмечает, что данная реакция протекает по цепному радикальному механизму. В классах с углубленным изучением химии или для учащихся с высоким уровнем подготовки имеет смысл рассмотреть механизм радикального замещения на данном уроке. Он подробно изложен в § 3 учебника. Именно механизм реакции объясняет, почему при бромировании алканов более сложного строения атом галогена замещает водород при наименее гидрированном атоме углерода.
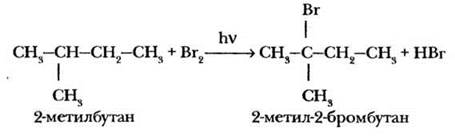
Большая роль в изучении цепного радикального механизма реакций принадлежит советскому ученому, академику Н. Н. Семенову. За работы в этой области он единственный из наших соотечественников в 1956 г. получил Нобелевскую премию по химии.
Такой же механизм радикального замещения характерен и для реакции нитрования предельных углеводородов. Эту реакцию в I 1888 г. открыл русский химик-органик Михаил Иванович Коновалов, чье имя реакция носит и поныне. По меткому выражению Н. Д. Зелинского, Коновалов «оживил химических мертвецов», коими в то время считались парафиновые углеводороды (учащиеся вспоминают: «парафин» означает «малоактивный»).
Урок, посвященный химическим свойствам алканов, получится пресноватым без демонстрационного эксперимента. Но что можно показать, кроме горения углеводородов? Оказывается, достаточно несложно продемонстрировать крекинг алканов. Понятие «крекинг» ребятам уже знакомо. Подготавливая прибор для получения газов, учитель попутно выясняет, как учащиеся запомнили сущность этого процесса.
В пробирку помещают примерно 1 см3 парафина. Расплавляют его на водяной бане, затем добавляют 2 см по высоте пористого материала (силикагель, кусочки кирпича или стекловата). Сорбент должен пропитаться парафином. Затем в пробирку помещают катализатор: гранулы оксида алюминия, пемзы или неглазурованного фарфора. Собрав прибор для получения газов в соответствии с рисунком 6, сильно прогревают катализатор. Затем необходимо слегка прогреть сорбент с парафином для образования паров алканов. Горелку следует перемещать от катализатора к сорбенту и обратно до тех пор, пока не наберется 2-3 пробирки газа. Первую можно не использовать, т. к. в ней содержится много воздуха. Пробирки закрыть пробками. Во избежание обратного засасывания жидкости нагревание прекращать только после того, как газоотводная трубка будет вынута из воды!
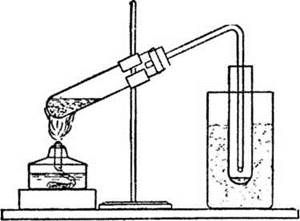
Рис. 6. Прибор для демонстрации крекинга алканов
Ребятам предлагается вопрос: как обнаружить, прошел ли процесс крекинга? Обнаружить в газоотводных продуктах алканы с меньшей молекулярной массой сложно: качественных реакций на предельные углеводороды нет. Однако помимо алканов продуктами крекинга являются непредельные углеводороды. Они должны обесцвечивать бромную воду, в чем можно убедиться практически.
Вообще при нагревании алканов без доступа воздуха с ними происходят самые разнообразные превращения, причем практически важные, используемые в промышленности. Учитель приводит реакции пиролиза с образованием углерода (сажи) и водорода, а также ацетилена.
Итак, исходя из парафинов, можно получить углеводороды с двойной и тройной связью. Но это не все. Алканы с шестью и более атомами углерода в цикле в присутствии катализатора превращаются в ароматические углеводороды за счет отщепления четырех молекул водорода. Процесс называется ароматизацией алканов и используется в промышленности для повышения качества бензина и получения аренов.
Для гомологов метана возможно протекание еще одного практически важного процесса: реакции дегидрирования. Такая реакция также протекает в присутствии катализатора при повышенной температуре и приводит к образованию этиленовых углеродов, о которых пойдет речь на следующих уроках:
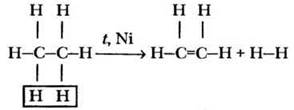
В заключение учитель обобщает информацию о химических свойствах алканов (рис. 7). Прежде всего, при комнатной температуре это весьма инертные соединения, не взаимодействующие с агрессивными веществами (концентрированными кислотами, щелочами, окислителями типа перманганата калия). Наиболее типичны для алканов реакции радикального замещения (галогенирования, нитрования). При нагревании предельные углеводороды претерпевают реакции дегидрирования, а также разложения (крекинг, пиролиз).
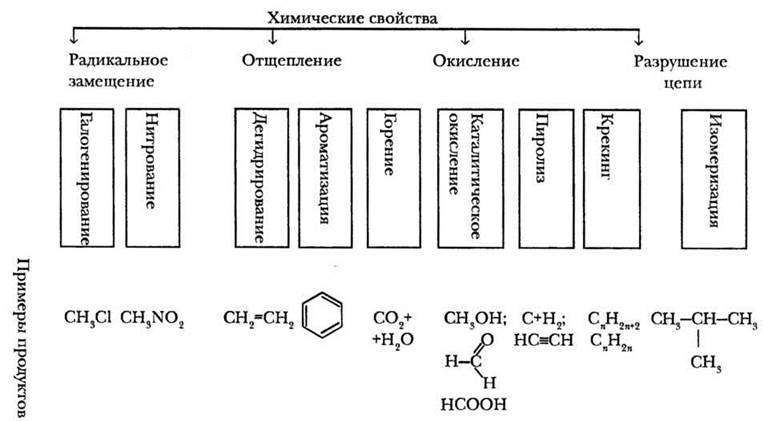
Рис. 7. Типы химических свойств передельных углеводородов
II. Применение предельных углеводородов
Подобно тому как строение вещества определяет его реакционную способность, свойства во многом обуславливают области применения соединения. В заключение урока учитель суммирует знания школьников об областях применения предельных углеводородов.
Газообразные алканы — это не только бытовое и промышленное топливо, но и сырье для химической промышленности. Из них получают галогенопроизводные, в том числе полностью фторированные углеводороды (фреоны), являющиеся хладоагентами бытовых и промышленных холодильников и кондиционеров. Метан идет на производство ацетилена. И кислородосодержащих соединений, из этана и пропана получают непредельные углеводороды и далее полимерные материалы. Жидкие углеводороды — это, прежде всего, топливо для двигателей различного типа (сверхзвуковой самолет потребляет до 100 л керосина в минуту!), растворители, сырье для получения алкенов.
Учитель просит ребят внимательно понаблюдать за горением спички. Древесина пропитана парафином, чтобы горение было равномерным и более медленным. Присмотревшись, можно увидеть, как плавится парафиновый слой. Если провести ногтем или ребром монеты по фантику от конфеты (нужно найти парафинированные), соскребается белый налет: бумага покрыта тонким слоем парафина для придания водо- и жироотталкивающих свойств.
Задания для закрепления материала данного урока могут включить цепочки превращений и задачи на расчет по химическому уравнению. Необходимо обратить внимание учащихся на необходимость указания условий протекания реакций в цепочках превращений.
Задание 1
При помощи каких реакций можно осуществить следующие превращения? При необходимости укажите условия протекания реакций.
1-й уровень
![]()
2-й уровень
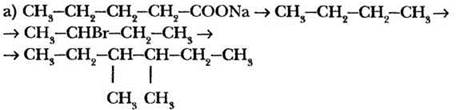
б) этан → бромэтан → н-бутан → изобутан → оксид углерода (IV).
Задание 2
1-й уровень
Какой алкан был подвергнут бромированию, если продуктом реакции является 2-бромбутан? Напишите уравнение реакции и укажите условия ее протекания.
2-й уровень
Напишите уравнения реакции Коновалова для этана, пропана и изобутана. В каком случае будет наблюдаться наибольший выход продукта?
Задание 3
1-й уровень
Какой объем метана ( при нормальных условиях) можно получить при гидролизе 28,8 г карбида алюминия?
2-й уровень
Какой объем этана был подвергнут каталитическому дегидрированию, если выделившегося водорода хватило для восстановления вольфрама из 11,6 г оксида вольфрама (VI)?