Настольная книга учителя химии 10 класс - поурочные разработки
ГОМОЛОГИЧЕСКИЙ РЯД ЭТИЛЕНОВЫХ УГЛЕВОДОРОДОВ, ИЗОМЕРИЯ И НОМЕНКЛАТУРА - УГЛЕВОДОРОДЫ
Цели урока. Познакомить учащихся с гомологическим рядом, химическим и электронном строении, изомерии и номенклатуре алканов. Развивать полученные ранее первоначальные теоретические представления об изомерии (в том числе и геометрической) и умения давать названия соединениям по номенклатуре ИЮПАК.
Оборудование: модели молекул Стюарта — Бриглеба.
I. Понятие непредельных углеводородов
Учитель начинает урок с выяснения вопроса, как учащиеся поняли термин «предельные» углеводороды. Разумеется, коль существуют углеводороды предельные, должны быть и непредельные. К непредельным углеводородам относятся вещества, содержащие в своем составе кратные углерод-углеродные связи: двойную С=С или тройную С≡С. Термин «непредельные» объясняется способностью этих соединений вступать в реакции присоединения с разрывом кратных связей, превращаясь при этом в предельные (насыщенные) углеводороды или их производные. Простейшими непредельными углеводородами являются соединения с одной двойной связью. Первый представитель этого класса углеводородов — этилен СН2=СН2.
Впервые этилен был получен в 1669 г. немецким химиком Иоганном Йохимом Бехером нагреванием этилового спирта с концентрированной серной кислотой. Современники не смогли по достоинству оценить открытие ученого. Ведь Бехер не только синтезировал новый углеводород, но и впервые применил химический катализатор (серная кислота) в процессе реакции. До этого в научной практике и повседневной жизни применялись только биологические катализаторы природного происхождения — ферменты. Проводя связь между общей, неорганической и органической химией, учитель просит ребят вспомнить, что такое катализатор, какие каталитические процессы изучались в курсе неорганической химии, назвать катализаторы, которые в них использовались.
Этилен более 100 лет после его открытия не имел собственного названия. В конце XVTII в. выяснилось, что при взаимодействии с хлором «газ Бехера» превращается в маслянистую жидкость, после чего его назвали олефином, что значит рождающий масло. Затем это название распространилось на все углеводороды, которые имели подобное этилену строение.
Этиленовыми (олефиновыми) углеводородами или алкенами называются углеводороды, содержащие в своем составе одну двойную углерод-углеродную связь С=С.
II. Электронное и пространственное строение этилена
Учитель пишет на доске структурную формулу любого алкана. В каком состоянии гибридизации находятся атомы углерода в этом состоянии? С этого вопроса можно начать повторение весьма сложного для понимания материала — валентные состояния атома углерода. Все углеродные атомы имеют одинаковый тип гибридизации — sp3. Каково взаимное расположение осейsp3-гибридных орбиталей в пространстве? Какие еще типы гибридизации ребята знают?
В этилене оба атома углерода, связанные двойной связью, находятся в состоянии sp2-гибридизации. Учитель напоминает, что в этом состоянии атом углерода имеет три sp3-гибридные орбитали и одну негибридизованную р-орбиталь. Оси sp2-орбиталей лежат в одной плоскости. Угол между ними составляет 120°. Ось р-орбитали перпендикулярна этой плоскости (рис. 8).
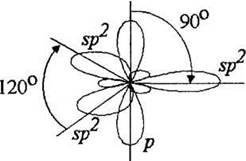
Рис. 8. Взаимное расположение орбиталей атома углерода в состоянии sp2-гибридизации
Каждый атом за счет прекрывания sp2-орбиталей образует три σ-связи: с двумя атомами водорода и соседним атомом углерода. При параллельном расположении осей p-орбиталей двух атомов возникает их боковое прекрывание с образованием второй углерод-углеродной связи π-типа (рис. 9).
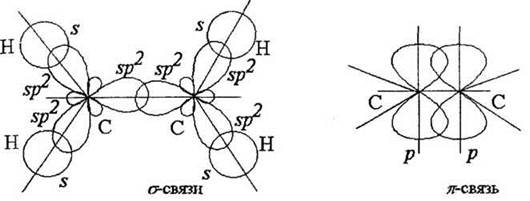
Рис. 9. σ- и π-связи в молекуле этилена
π-связь менее прочна и более доступна для атаки электрофильных реагентов по сравнению с σ-связью. Однако суммарная энергия двойной связи больше, чем одинарной.
Электронное строение молекулы этилена определяет ее пространственное строение. Центры ядер всех шести атомов расположены в одной плоскости, перпендикулярной плоскости п-связи. Все валентные углы ∠HCC, ∠HCH близки к 120°. Длина двойной связи значительно меньше длины одинарной и составляет 0,133 нм. Благодаря двоесвязанности атомов углерода, свободное вращение относительно связи С=С невозможно.
III. Гомологический ряд алкенов. Изомерия и номенклатура
Этилен, подобно метану, является родоначальником целого ряда углеводородов сходного строения — гомологического ряда алкенов. Как и в случае алканов, два ближайших гомолога отличаются по составу на группу — СН2—, называемую гомологической разностью. Учитель демонстрирует, как получить формулу следующего представителя гомологического ряда этиленовых углеводородов. Для этого один из атомов водорода в молекуле этилена нужно заменить на метиловый радикал. Поскольку все водородные атомы в этилене одинаковы (эквивалентны), существует только один изомер состава C3H6. Этот углеводород носит название пропилен или, в соответствии с международной номенклатурой, пропен.
Аналогичным образом можно построить из молекулы пропена структурные формулы следующего гомолога — бутена. Учитель просит ребят внимательно посмотреть на структуру С3Н6 и обратить внимание, что атомы водорода в ней уже не эквивалентны! Их можно разделить на группы группы: три водорода метильной группы, один атом Н у центрального углерода и два водородных атома при С(1). Уже этот факт позволяет предположить, что изомеров у бутена несколько! Поочередно заменяя на метильную группу атомы водорода каждого типа, учитель изображает формулы бутена-1, 2-метилпропена. Эти изомеры отличаются строением углеродного скелета. Теперь остается заменить на метил атомы водорода при С(1), сначала «верхний», потом «нижний». Будуг ли это различные вещества, разные изомеры? Да, поскольку вращение относительно двойной С=С связи (в отличие от одинарной) невозможно! Ученики вспоминают, что такой тип изомерии называется геометрической или цис-транс-изомерией.
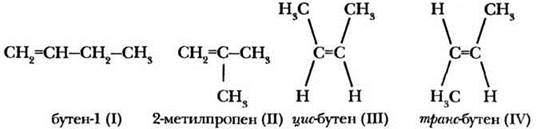
Пары структур (I) и (III), а также (I) и (IV) демонстрируют еще один, новый по сравнению с алканами тип изомерии — изомерию положения двойной связи.
Преподаватели со стажем знают, что некоторые моменты, тривиальные для учителя, совсем не очевидны для учащихся. На них нужно обращать внимание, проверить, насколько они усвоены. Приведем два подобных положения в качестве примера.
1. В алкенах из всех углеродных атомов только два, связанные кратной связью, находятся в состоянии sp2-гибридизации, остальные атомы имеют sp3-конфигурацию. Как же определить тип гибридизации в общем случае, для любого атома С? Если атом углерода связан с четырьмя другими атомами, он находится в состянии sp3-гибридизации, если с тремя соседями — в sp2-гибридизации, с двумя — это состояние sp-гибридизации.
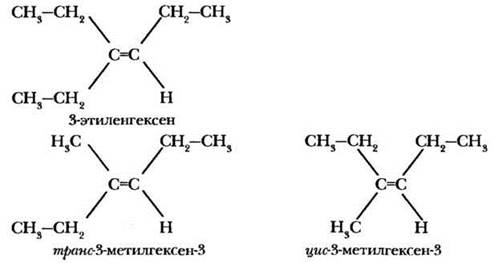
2. Не любой алкен имеет пространственные изомеры. По какому признаку можно определить, есть ли у данного олефина цис-транс-изомеры? Для этого необходимо, чтобы каждый из двух атомов углерода при двойной связи имел по два различных заместителя. Например, у 3-этилгексена-3 пространственных изомеров нет (у третьего углеродного атома два этильных заместителя), а 3-метилгексен-3 — цис-отраис-изомеры имеет. Их изображение начинают с атомов углерода, связанных двойной связью, затем указывают четыре заместителя, с ними связанные:
Ребята сами выведут общую формулу гомологического ряда алкенов:
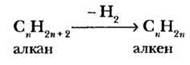
На приведенных выше примерах учитель показывает особенности номенклатуры алкенов. Самая длинная цепь должна содержать двойную связь и нумеруется с того конца, к которому она ближе. При расположении кратной связи в центре цепи, нумерацию ведут от атома углерода, к которому ближе разветвление. В основе названия — наименование алкана с тем же числом углеродных атомов, при этом суффикс -ан меняется на -ен. Положение и названия заместителей указываются перед основой названия, а положение двойной связи в цепи — после. Если необходимо указать тип пространственного изомера, перед названием добавляют префиксы цис- или транс-.
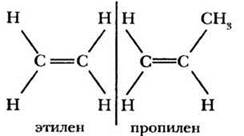
Простейшие алкены, наряду с международными терминами, (этен, пропен и бутен), часто обозначают исторически сложившимися названиями (этилен, пропилен, бутилен): ![]()
При отщеплении одного атома водорода от молекул алкенов образуются непредельные радикалы общей формулы СnН2n-1 простейшие из которых называются: винил СН2=СН— и аллил СН2=СН-СН2-.
В заключение урока учитель должен на ряде примеров закрепить умение учащихся составлять структурные формулы алкенов и давать им названия. Особое внимание для 2-го уровня следует уделить написанию структур геометрических изомеров.
Задание 1
Напишите структурные формулы следующих углеводородов:
1-й уровень
Цис-бутен-2; 2-метилпентен-2; транс-гексен-3.
2-й уровень
2,3-диметилбутен-1; транс-4-метилпентен-2; цис-4-метил-4-этилгексен-2.
Задание 2
Напишите структурные формулы всех возможных изомеров пентена (1-йуровень) или гексена (2-йуровень), назовите углеводороды по международной номенклатуре.
Задание 3
1-й уровень
Плотность паров этиленового углеводорода по водороду равна 28. Определите его молекулярную формулу. Сколько изомеров имеет данный алкен?
2-й уровень
Массовая доля углерода в углеводороде составляет 85,7%, его пары в 2,41 раза тяжелее воздуха. Определите молекулярную формулу углеводорода, приведите формулы двух его гомологов.