Настольная книга учителя химии 10 класс - поурочные разработки
ПОЛУЧЕНИЕ И ХИМИЧЕСКИЕ СВОЙСТВА ЭТИЛЕНОВЫХ УГЛЕВОДОРОДОВ - УГЛЕВОДОРОДЫ
Цели урока. Рассмотреть промышленные и лабораторные способы получения алкенов. Развивать общие представления о типах химических реакций и механизмах их протекания на химических свойствах этиленовых углеводородов. Дать представление о химии полимеров и реакциях полимеризации. Познакомить с пластмассами и их значением в жизни современного общества.
Оборудование: этиловый спирт, H2SO4 (конц.), бромная вода, раствор КМnO4, прибор для получения газов. Демонстрационные образцы: пленка и изделия из полиэтилена, полипропилена, тефлона, поливинилхлорида; модели молекул Стюарта — Бриглеба.
I. Получение этиленовых углеводородов
В отличие от предельных углеводородов алкены встречаются в природе нечасто. При объяснении способов получения углеводородов данного класса учитель придерживается общей схемы. Все способы получения алкенов делятся на две группы: промышленные и лабораторные (рис. 10).
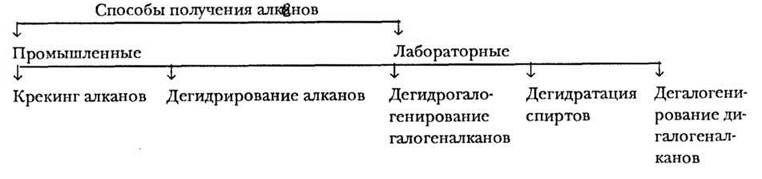
Рис. 10. Способы получения этиленовых углеводородов
Промышленные способы — это уже изученные ранее крекинг и дегидрирование алканов. Учитель предоставляет ученикам возможность самим написать схемы крекинга ряда предельных углеводородов, например, октана, бутана, 2,3-диметил бутана. В первом случае следует обратить внимание, что из возможных изомеров бутена, различающихся положением двойной связи, преимущественно образуется бутен-2. Аналогично при каталитическом дегидрировании бутана в смеси продуктов также преобладает бутен-2.
Все лабораторные способы получения алкенов основаны на реакциях элиминирования. При этом от двух соседних атомов углерода отщепляются два атома или группы, а освобождающиеся валентности образуют п-связь.
Термины «дегидрогалогенирование», «дегидратация», «дегалогенирование» учащиеся часто путают, запоминают с трудом и произносят «с разбегу», с третьей попытки. Надо обязательно разобрать слово по косточкам, расшифровав каждую его часть.
Например, реакция дегидрогалогенирования:
де + гидро + галоген + ирование = удалять + водород + галоген + (действие)
Что получилось? Отщепление галогеноводорода.
При рассмотрении реакции дегидрогалогенирования учитель делает акцент на двух принципиально важных моментах.
1. В органических реакциях, как и в неорганической химии, большое значение имеют условия проведения процесса. Подчас от этого зависит строение образующихся продуктов. Например, на воздухе аммиак горит с образованием азота, а окисление в присутствии катализатора позволяет из тех же исходных веществ получить оксид азота (II):
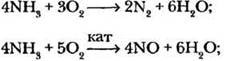
Следовательно, делают умозаключение учащиеся, катализаторы изменяют не только скорость химической реакции, но и ее направление. Направление реакции зависит также и от условий ее проведения.
Например, при взаимодействии гидроксида натрия с хлором при комнатной температуре в качестве одного из продуктов образуется гипохлорит натрия, а при нагревании — хлорат натрия:
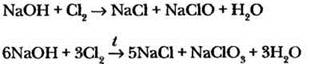
В органической химии влияние условий проведения реакции (температура, растворитель, присутствие и тип катализатора) еще более заметно. Возвращаясь к получению алкенов, учитель обращает внимание на то, что отщепление галогеноводорода происходит под действием спиртового раствора щелочи при нагревании. Использование водного раствора приводит к образованию совсем другого продукта.
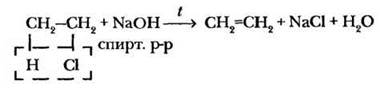
В качестве исходных веществ для такой реакции лучше брать хлор — или бромалканы, а также гидроксиды натрия или калия.
2. Если есть возможность отщепления галогенводорода несколькими различными способами, преимущественно реализуется тот, при котором атом водорода отщепляется от наименее гидрированного (с меньшим числом водородных атомов) атома углерода, т. е. образуется алкен с большим числом алкильных заместителей при двойной связи. Эта закономерность открыта в 1875 г. выдающимся русским химиком, учеником и полным тезкой Бутлерова Александром Михайловичем Зайцевым и носит название правило Зайцева.
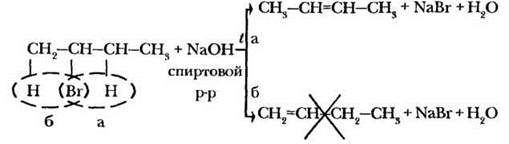
По существу реакция дегидратации — полная аналогия реакции дегидрогалогенирования. У учителя есть возможность еще раз отработать все использованные выше приемы, закрепить материал:
— «расшифровка» термина дегидратация: отщепление молекулы воды. Четверо из пяти школьников пишут это слово через «о», следует обратить внимание на правильное написание;
— важность условий проведения реакции: при температуре ниже 180 °С в качестве основного продукта получается диэтиловый простой эфир. Учитель напоминает, что именно в этой реакции впервые был использован катализ концентрированной серной кислотой:
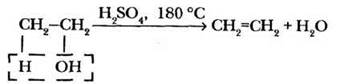
— отщепление молекулы воды для вторичных и третичных спиртов также определяется правилом Зайцева.
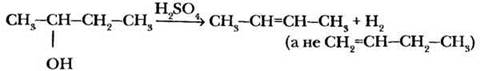
В качестве лабораторного способа получения можно привести и реакцию дегалогенирования (отщепления двух атомов галогена) дигалогеналканов, пример которой дается в учебнике. Вместо цинка в качестве металла может быть использован натрий или магний. Учитель просит сравнить данную реакцию с реакцией Вюрца, найти общие черты и различия между ними.
Для учащихся классов с углубленным изучением химии учитель может рассказать о том, что строение этилена было установлено А. М. Бутлеровым в 1860 г. Он исследовал взаимодействие дииодметана с металлами, получил этилен и сделал вывод, что между атомами углерода в продукте реакции должна быть двойная связь. Только в этом случае сохраняется четырехвалентность углерода.
![]()
II. Химические свойства этиленовых углеводородов
Следуя логической цепочке курса СОСТАВ → СТРОЕНИЕ → СВОЙСТВА → ПРИМЕНЕНИЕ, учитель акцентирует внимание на том, что свойства алкенов коренным образом отличаются от свойств алканов. Конечно же, это связано с наличием в этиленовых соединениях двойной связи. Если для алканов наиболее типичны процессы радикального замещения, то алкены склонны к реакциям присоединения, окисления и полимеризации. Учителю в объяснении материала и учащимся для лучшего запоминания поможет опорный конспект (рис. 11).
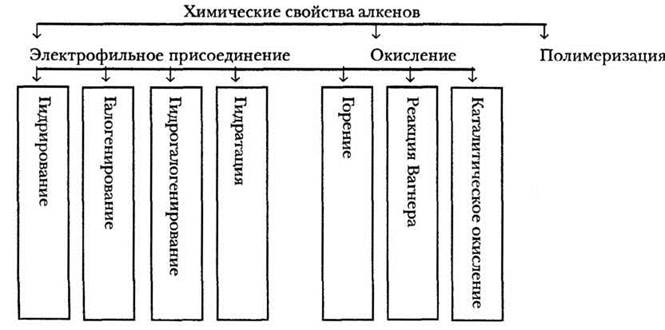
Рис. 11. Химические свойства этиленовых углеводородов
1. Реакции присоединения. Учитель обращает внимание, что из двух химических связей, которыми связаны sp2-гибридные атомы углерода в алкенах, наиболее подвижна, доступна для атаки и менее прочна π-связь. Именно она и «привлекает внимание» частиц реагентов. Поскольку двойная связь — это избыточная электронная плотность, то реагент должен быть электрофильным, реакция присоединения также будет носить электрофильный характер.
При рассмотрении данного материала настало время практического применения знаний об электронных эффектах, их значения при определении строения продуктов реакции. Учащимся необходимо вспомнить, что атомы и группы атомов могут обладать электронно-донорными свойствами, подавать электронную плотность или же оттягивать ее (электроноакцепторные свойства).
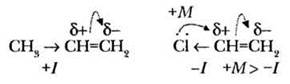
Если такое смещение происходит по цепи σ-связей, это индуктивный эффект, если задействованы п-связи или неподеленные электронные пары, такой эффект называется мезомерным. В обоих приведенных примерах электронная плотность двойной связи смещена к наиболее гидрированному атому углерода. Этим обстоятельством объясняется правило Марковникова:
В реакции присоединения полярных молекул (галогеноводородов, воды) к несимметричным алкенам атом водорода преимущественно присоединяется к наиболее гидрированному атому углерода по двойной связи.
Исследования выдающегося русского химика Владимира Васильевича Марковникова явились блестящим подтверждением теории химического строения его учителя, А. М. Бутлерова. Результаты этих исследований послужили основой учения о взаимном влиянии атомов, как одного из главных положений теории строения. В 1869 г. В. В. Марковников защитил докторскую диссертацию на тему: «Материалы по вопросу о взаимном влиянии атомов в химических соединениях».
Правило Марковникова определяет строение продуктов присоединения к алкенам галогеноводородов и воды.
1). Гидрогалогенирование и гидратация алкенов. Для лучшего понимания и запоминания этих терминов учитель проводит аналогию с реакциями элиминирования, начинающихся с частицы «де»: дегидрогалогенирование, дегидратация. Это реакции, обратные получению этиленовых углеводородов. Хлороводород и бромоводород могут присоединяться к алкенам в газовой фазе, присоединение воды требует кислотного катализатора (в качестве последнего используется серная или фосфорная кислота).
![]()

2). Галогенирование. Алкены легко присоединяют молекулы галогенов (хлор, бром) с разрывом двойной связи и образованием дигалогенпроизводных:
![]()
Реакция может идти и в гетерогенной системе между газообразным или жидким алкеном и водным раствором брома (бромной водой), при этом бромная вода, имеющая желто-коричневую окраску, обесцвечивается. Учитель подчеркивает, что данная реакция является качественной на двойную углерод-углеродную связь.
3). Гидрирование. Присоединение водорода по двойной связи алкенов происходит в присутствии металлических катализаторов. Иногда для этого требуется повышение давления или температуры. Наиболее распространенными катализаторами процессов гидрирования и дегидрирования является никель.
![]()
Для правильного написания продуктов присоединения к алкенам учитель обращает внимание ребят на то, что углеродный скелет в этих процессах не претерпевает изменений.
2. Реакции окисления. Особенностью химических свойств соединений с двойной углерод-углеродной связью является их легкое окисление.
Пожалуй, теперь самое время для небольшой разрядки — демонстрационного эксперимента. Учитель получает этилен дегидратацией этилового спирта как описано в главе 2 (урок 1), демонстрирует обесцвечивание бромной воды, водного раствора перманганата калия. При этом обращает особое внимание на то, что обе эти реакции являются качественными на этилен и его гомологи. Затем учитель поджигает выделяющийся этилен, сравнивая цвет его пламени с пламенем газовой горелки (или зажигалки). Учащиеся наблюдают: этилен горит красноватым светящимся пламенем, в то время как пламя предельных углеводородов голубое. Это происходит потому, что массовая доля углерода в алкенах несколько выше, чем в алканах с тем же числом атомов углерода. Такая тенденция сохранится и для других типов углеводородов.
Реакцию окисления олефинов водным раствором перманганата калия открыл в 1888 г. русский химик с немецкой фамилией: Егор Егорович Вагнер. С помощью этой качественной реакции Вагнер доказал непредельный характер некоторых природных соединений: терпенов, лимонена, скипидара. С тех пор эта реакция носит имя ученого — реакция Вагнера.
В результате реакции двойная связь разрывается, и оба атома углерода присоединяют по гидроксильной группе —ОН. Образующиеся соединения такого класса называются гликолями. Окислитель в данной реакции можно условно обозначать символом атома кислорода в квадратных скобках [О], как это приводится в учебнике. Для сильных учащихся не составит труда написать уравнение этой реакции как в нейтральной, так и в кислой или щелочной среде, и даже уравнять ее методом электронного баланса.
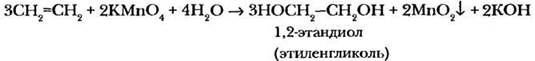
Очень важными промышленными процессами является каталитическое окисление этиленовых углеводородов. При использовании в качестве катализатора влажной смеси двух солей — хлорида палладия и хлорида меди (II) — получают ацетальдегид (Вакер-процесс). На сегодняшний день это лучший способ получения уксусного альдегида в промышленности:
![]()
При пропускании смеси этилена с воздухом над серебряным катализатором при 150-350 °С образуется оксид этилена, относящийся к классу эпоксидов.
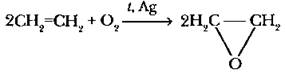
Оксид этилена широко используется в промышленности для получения эпоксидных смол, синтетических моющих средств, лаков, пластмасс, синтетических каучуков и волокон.
3. Реакции полимеризации. Самые первые представления о высокомолекулярных соединениях ребята получили в 9 классе. На примере реакции полимеризации этилена учитель закрепляет понятия: «полимер», «мономер», «структурное звено», «степень полимеризации».
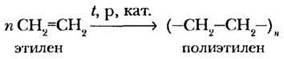
Тема «Полимеры» имеет особое значение в курсе органической химии. Полимерные вещества так широко распространены в технике, промышленности, в быту, повседневной жизни человека, что любой выпускник общеобразовательной школы должен ориентироваться в многообразии высокомолекулярных соединений, знать их основные свойства и характеристики. Хорошо, если учителю удастся выделить время на ознакомление с наиболее распространенными полимерными материалами, в увлекательной форме рассказать ребятам об истории их открытия, применения, свойствах, коснуться вопросов экологической безопасности распространения и утилизации пластмасс. Поскольку различные типы природных и синтетических полимеров будут рассматриваться в соответствующих разделах программы, в данной главе мы приведем краткую характеристику продуктов полимеризации олефинов и их производных.
Первые синтетические полимеры были получены главным образом случайно. По мере изучения процесса полимеризации и свойств образующихся продуктов эти исследования становились все более систематическими. В настоящее время нашу жизнь невозможно представить без полимерных материалов. Они все в большей степени вытесняют из нашего быта природные материалы, поскольку обладают уникальными и самыми разнообразными свойствами, сравнительно дешевы, легко обрабатываются, многие подлежат вторичной переработке.
Полимеры, которые способны изменять свою форму при нагревании или при деформации и сохранять ее после охлаждения или снятия усилия, называются пластмассами (пластиками).
С пластмассами люди познакомились значительно позже, чем с эластомерами (каучуком и родственными материалами). В 1933 г. группа исследователей под руководством Эрика Фосетта и Реджиналда Гибсона проводила опыты с этиленом при повышенном давлении. После вскрытия реактора они обнаружили белое вещество, похожее на воск. Элементный анализ показал, что эмпирическая формула этого вещества СН2. Воспроизвести опыт удавалось не всегда: в некоторых случаях происходил взрыв, иногда этилен не изменялся даже при очень высоком давлении. В 1935 г. опыты были возобновлены. Фосетт и Гибсон научились контролировать получение воскообразного вещества, изменяя температуру и давление. Работавший в той же лаборатории Майкл Перрин установил, что успешное протекание реакции зависит от присутствия в реакторе кислорода: при большом его содержании этилен со взрывом окислялся, в отсутствии кислорода реакция не протекала вообще.
Получив некоторое количество нового вещества, ученые продемонстрировали его уникальные свойства: оно легко плавилось, подвергаясь формованию, обладало хорошими электроизоляционными свойствами, отличалось уникальной химической инертностью. Вскоре выяснилось, что молекулы нового вещества имеют очень большую молекулярную массу: несколько сотен тысяч. Так установили полимерную природу вещества, названного полиэтиленом. Первое применение полиэтилен нашел в качестве изоляции электропроводов. В 1943 г. из полиэтилена стали изготавливать посуду, ящики, бутылки, упаковку, предметы домашнего обихода.
Полиэтилен, полученный Фосеттом и Гибсоном обладал рядом недостатков. Из-за сильной разветвленности макромолекул он имел низкую плотность и недостаточную механическую прочность. Такой материал называется полиэтилен высокого давления ПЭВД (или низкой плотности ПЭНП).
Новые перспективы использования полиэтилена появились в 1953 г. с открытием немецким ученым Карлом Циглером особых катализаторов процесса полимеризации — металлорганических соединений. Циглер установил, что в присутствии очень малых количеств TiCl4 и Al(C2H5)3 (триэтилалюминий) полимеризация протекает при комнатной температуре и атмосферном давлении. При этом получается полимер с молекулярной массой в несколько миллионов, большой плотностью за счет плотной упаковки практически линейных молекул и очень высокой механической прочностью. Такой продукт стали называть полиэтиленом низкого давления (ПЭНД). Он стал незаменимым материалом для производства труб, ведер, деталей машин, кухонной посуды, бытовых предметов. Выдающееся открытие К. Циглера было по достоинству оценено соотечественниками. Он не только стал профессором в 23 года, но и превратился к концу жизни в мультимиллионера, жертвуя значительные суммы на развитие науки.
Следующим логическим шагом в изучении полимеров стала попытка полимеризации пропилена. Впервые это удалось сделать в 1954 г. итальянскому ученому Джулио Натта с применением катализатора Циглера. Натта модифицировал катализатор таким образом, что полимерные цепочки «росли» с его поверхности, как волосы. Но главное, варьируя условия проведения процесса, можно было получать полимер не просто регулярного строения (метальные группы расположены через один атом углерода основной цепи), а изотактический или атактический. В первом метальные группы располагаются строго по одну сторону полимерной цепочки, во втором их расположение хаотично.
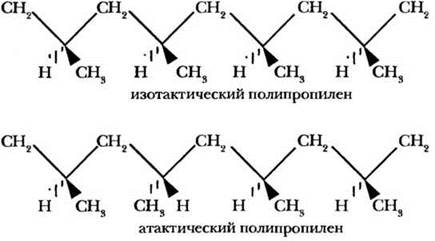
Изотактический полипропилен более ценен, обладает кристаллической структурой. Он тверд и прочен, из него изготавливают трубы, пленки, химическое оборудование, детали машин, канаты, нити для ковровых покрытий, детские игрушки. Атактический полиэтилен мягок и гибок, он идет на изготовление водостойких покрытий, кровельных материалов.
За выдающийся вклад в развитие химии полимерных материалов К. Циглер и Д. Натга в 1963 г. были удостоены Нобелевской премии.
Не меньшее значение в повседневной жизни играют полимеры на основе галогенопроизводных этиленовых углеводородов. Открытию этих соединений человечество также обязано Его Величеству Случаю (хотя «случайные» открытия удаются только тому, кто много и упорно работает, самоотверженно стремится к достижению поставленной цели). В 1938 г. американский ученый Р. Планкетт проводил опыты с тетрафторэтиленом CF2=CF2. Для удобства он наполнил этим газообразным веществом металлический баллон под давлением. На следующий день газа в баллоне не оказалось, а внутри лежал порошок молочно-белого цвета. Это и был политетрафторэтилен или тефлон
![]()
Тефлон имеет молекулярную массу от 0,5 до 2 млн. и обладает исключительной химической устойчивостью. На него не действуют ни расплавленные щелочи, ни концентрированные кислоты, ни даже царская водка, растворяющая золото. Он не набухает в воде, устойчив в интервале температур от -250 до +200 °С, не хрупок даже при сильном охлаждении. Тефлон обладает очень низким коэффициентом трения. Из него изготавливают подшипники и втулки, детали химических аппаратов и машин, оболочки высоковольтных кабелей и пленки.
Однако и тефлон не лишен недостатков. Минуя жидкое агрегатное состояние, при температуре более 400 °С он разлагается, поэтому из него невозможно отливать изделия обычным способом. Этого недостатка лишены другие полимеры на основе галогеналкенов. Из хлорэтилена, который чаще называют винилхлоридом, получают ценный полимер — поливинилхлорид.
![]()
Этот полимер с молекулярной массой 100-150 тыс. гибок, эластичен, облагает прекрасными электроизоляционными свойствами. Из него изготавливают трубки, изоляцию электропроводов, изоленту, пленки, искусственную кожу.
Учителю стоит обратить внимание на замечательные пророческие слова Джулио Натта, написанные им в 1957 г.:
«Химик, собирающийся построить гигантскую молекулу, находится в таком же положении, как и архитектор, проектирующий здание. В его распоряжении имеется ряд строительных блоков определённых форм и размеров, и он должен соединить их вместе в структуру, которая будет служить определенной цели. Химия полимеров в настоящее время становится все более привлекательной областью исследований; в последние несколько лет открыты новые пути соединения блоков вместе — открытия, которые сулят получение большого количества материалов, прежде никогда не существовавших на Земле».
Способы получения и химические свойства этиленовых углеводородов необходимо закрепить решением типовых упражнений. Олефины — удобная тема для отработки задач на нахождение формулы органического вещества расчетом по химическому уравнению (задание 3). Примерные варианты заданий могут быть такими.
Задание 1
1-й уровень
Какие алкены получатся при дегидробромировании следующих галогеналканов:
а) 1-бромпропан; б) 3-бромпентан; в) 2-метил-3-бромбутан?
Напишите уравнения соответствующих реакций, укажите условия их протекания.
2-й уровень
Напишите реакции получения перечисленных алкенов дегидратацией соответствующих спиртов и дегидрогалогенированием галогеналканов:
а) пропен; б) 2-метилбутен-2; в) 2,3-диметилбутен-1.
Укажите условия проведения реакций.
Задание 2
1-й уровень
С помощью каких реакций можно осуществить следующие превращения? При необходимости укажите условия протекания реакций:
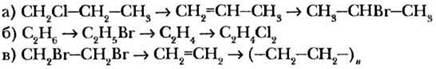
2-й уровень
С помощью каких реакций можно осуществить следующие превращения? При необходимости укажите условия протекания реакций:
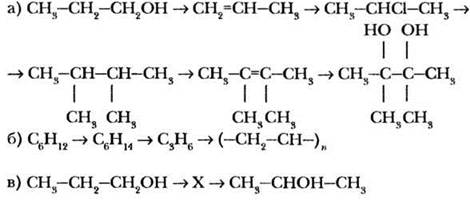
Задание 3
1-й уровень
Этиленовый углеводород массой 7,0 г обесцвечивает 640 г бромной воды с массовой долей брома 2,5%. Определите молекулярную формулу алкена.
2-й уровень
Какова структурная формула этиленового углеводорода, если 11,2 г его при взаимодействии с избытком НВr превращается в 27,4 г бромалкана с положением галогена у третичного атома углерода?