Настольная книга учителя химии 10 класс - поурочные разработки
ОБОБЩЕНИЕ ЗНАНИЙ ПО ТЕМЕ: «УГЛЕВОДОРОДЫ» - УГЛЕВОДОРОДЫ
Цели урока. Дать понятие о генетической связи между классами органических соединений и генетическом ряде углеводородов. Повторить, обобщить и систематизировать знания учащихся об этом типе веществ на основе сравнительной характеристики состава, строения и свойств основных классов углеводородов. Развивать на химии этих соединений логические операции мышления.
Оборудование: схемы, слайды, кодограммы по классификации и сравнительной характеристике углеводородов.
I. Генетическая связь между различными классами углеводородов
Данный урок имеет цель сформировать у учащихся целостное представление об углеводородах различных классов, продемонстрировать их генетическую взаимосвязь, подчеркнуть решающее влияние строения органического соединения на его химические свойства. Урок целесообразно провести в форме семинара, на котором учитель посредством беседы систематизирует и корректирует знания учащихся, устанавливает причинно-следственную связь в цепочке понятий
СОСТАВ - СТРОЕНИЕ - СВОЙСТВА.
Во вводной части урока учитель подчеркивает значение углеводородов для современных отраслей промышленности, техники, повседневной жизни людей. Эти вещества, как в индивидуальном состоянии, так и в виде природных смесей (газ, нефть, уголь), служат сырьем для производства десятков тысяч более сложных органических соединений, несут в наши дома тепло и свет. Без них из обихода исчезли бы многие привычные вещи: изделия из пластмасс, резины, средства бытовой химии, косметика.
В чем же кроются причины многообразия углеводородов? Отвечая на этот вопрос, школьники обращаются к понятиям гомологического ряда, изомерии, способности атома углерода соединяться друг с другом в длинные цепочки, образовывать кратные связи.
Повторить классификацию углеводородов и генетическую связь между различными типами помогает схема, пример которой представлен на рисунке 19. Она может быть заранее выполнена в виде плаката, слайда или пленки для кодоскопа.
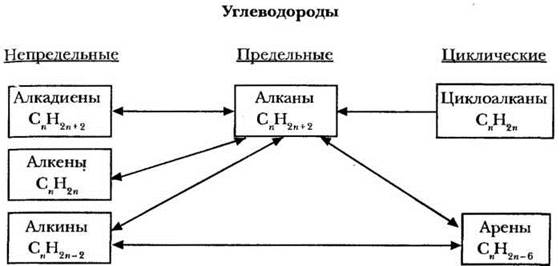
Рис. 19. Классификация и генетическая связь углеводородов
Учитель просит сформулировать отличительный признак каждой группы углеводородов. Предельные до предела насыщены атомами водорода, не содержат кратных связей или цикла; непредельные имеют хотя бы одну двойную или тройную связь между атомами углерода; циклические содержат замкнутую цепочку углеродных атомов.
Как отличаются углеводороды по составу? Гомологи различаются на одну или несколько групп СН2 (гомологическая разность), непредельные и циклические — меньшим числом водородных атомов по сравнению с углеродными. Отсюда следует первый важный вывод: превратить углеводороды одного типа в другой можно с помощью присоединения или отщепления атомов водорода. Этот метод пригоден для большинства переходов, однако не является универсальным. Стрелками на схеме связаны углеводороды, которые можно непосредственно превратить друг в друга одной реакцией. Для иллюстрации сказанного учитель предлагает осуществить несколько цепочек превращений (генетических переходов):
этан → этилен → ацетилен → бензол
бензол → циклогексан → н-гексан → пропен
метан → ацетилен → этилен → этан
2-метилбутан → 2-метилбутадиен-1,3 → 2-метилбутен-2
По возможности учитель повторяет мысль о взаимосвязи органических и неорганических веществ, живой и неживой природы. Например, метан можно получить из неорганического вещества карбида алюминия, ацетилен — из карбида кальция, смесь предельных J углеводородов 6-12 атомами углерода получают из смеси СО и H2 (синтез-газ). С другой стороны, все углеводороды при сгорании образуют неорганические продукты.
II. Взаимосвязь СОСТАВА — СТРОЕНИЯ — СВОЙСТВ углеводородов
Тесную взаимосвязь между этими понятиями учитель демонстрирует на примере. Учащиеся с места характеризуют предельные углеводороды по вопросам учителя.
— Общая формула алканов? СnН2n+2
— Тип гибридизации атомов углерода? sp3
— Наиболее характерные химические свойства? Реакции замещения.
Представим, что состав алкана уменьшился на 2 атома водорода, формула его стала СnН2n. Такое изменение должно обязательно отразиться на строении молекулы. В углеводороде появляется либо двойная связь, либо цикл. В первом случае два атома в молекуле изменяют тип гибридизации, химические свойства резко изменяются. Какие реакции характерны для алкенов? (Присоединение, окисление, полимеризация). И для алкенов, и для циклоалканов появляется возможность пространственной (цис-транс-) изомерии. Химическое поведение циклоалканов в значительной мере зависит от размера цикла и может напоминать свойства как предельных, так и непредельных углеводородов.
Большинство педагогов для обобщения знаний о свойствах различных типов углеводородов использует табличную форму. Ее наглядность, эффективность, возможность проводить сравнения и аналогии проверена временем. Некоторые учителя предпочитают задавать выполнение таблицы в качестве домашнего задания для подготовки к уроку-обобщению, кто-то считает целесообразным ее заполнение на уроке совместно с учащимися. Наполнение таблицы как по вертикали, так и по горизонтали может быть различно. Мы считаем, что включение в нее алкадиенов излишне, поскольку они во многом родственны алкенам. Строки но горизонтали должны содержать информацию и по строению, и но химическим свойствам углеводородов (табл. 1).
Таблица 1. Сравнительная характеристика углеводородов
|
Общая формула |
Алканы СnН2n+2 |
Алкены СnН2n |
Алкины СnН2n-2 |
Циклоалканы СnН2n |
Арены СnН2n-6 |
|
Нахождение в природе |
Да |
Нет |
Нет |
Да |
Да |
|
Тип гибридизации ключевых атомов углерода |
sp3- |
sp2- |
sp- |
sp3- |
sp2- |
|
Отличительный признак |
Все связи одинарные С-С |
Есть одна двойная связь С=С |
Есть тройная связь C≡С |
Есть цикл |
Бензольное кольцо |
|
Тип ковалентной связи |
σ-связи |
σ- и п-связи |
σ- и π-связи |
σ-связи |
σ- и π-связи |
|
Характерные типы изомерии |
Углеродного скелета |
Углеродного скелета, положения кратной связи. Геометрическая |
Углеродного скелета, положения кратной связи |
Углеродного скелета (размер цикла и положение заместителей). Геометрическая |
Углеродного скелета (заместителей и их взаимного положения в цикле) |
|
Типичные химические свойства |
Радикальное замещение |
Присоединение, замещение, полимеризация |
Присоединение. Кислотные свойства ≡С-Н |
В зависимости от размера цикла присоединение или замещение |
Электрофильное замещение |
|
Отношение к раствору КМnО4 |
Не реагируют |
Обесцвечивание |
Обесцвечивание |
Не реагируют |
Окисление заместителей в цикле |
|
Взаимодействие с галогенами |
Радикальное замещение |
Присоединение |
Присоединение |
Присоединение или радикальное замещение |
Электрофильное (по кольцу) или радикальное (по боковой цепи) замещение |
|
Каталитическое гидрирование |
Нет |
Да |
Да |
Да |
Да |
Учащиеся часто ошибаются, полагая, что все атомы углерода, например, в алкенах находятся в состоянии sp2-гибридизации. Поэтому учитель подчеркивает, что в третьей строке речь идет только об атомах, определяющих принадлежность вещества к тому или иному типу углеводородов.
Строку, касающуюся взаимодействия с галогенами, учитель с учениками иллюстрируют уравнениями химических реакций с обязательным указанием условий их проведения. Важно, чтобы ребята запомнили: от условий реакции зависит как возможность ее осуществления (алканы не взаимодействуют с бромной водой, но при освещении реагируют с газообразным бромом), так и направление протекания (гомологи бензола на свету бромируются по боковой цепи, в присутствии катализатора — по кольцу).
В заключение урока целесообразно решить несколько задач на определение типа и формулы углеводорода по массовым долям элементов, продуктам сгорания или химическим свойствам.
Задание 1
1-й уровень
Массовая доля углерода в алкане составляет 82,76%. Определите молекулярную формулу вещества, напишите структурные формулы его изомеров и назовите их.
2-й уровень
Массовая доля углерода в углеводороде составляет 85,7%, плотность его паров при нормальных условиях — 2,5 г/л. Составьте структурные формулы всех возможных изомеров и назовите их по международной номенклатуре.
Задание 2
1-й уровень
При сгорании некоторого количества углеводорода образовалось 5,6 л (н. у.) оксида углерода (IV) и 3,6 г воды. Определите формулу углеводорода, если плотность его паров по водород) равна 34.
2-й уровень
Определите молекулярную формулу предельного углеводорода, если при полном сгорании его образца в кислороде образуется 11,2 л СO2 (н. у.) и 10,8 г водяных паров. Составьте структурную формулу изомера данного углеводорода с четвертичным атомом углерода и назовите его.
Задание 3
1-й уровень
Некоторый углеводород обесцвечивает водные растворы брома и перманганата калия, а при гидрохлорировании образует 2-хлорбутан. Определите формулу углеводорода, если известно, что он не имеет цис-транс-изомеров. Напишите уравнения всех упомянутых реакций.
2-й уровень
Вещество А при пропускании над раскаленным углем образует смесь изомеров Б и В. При реакции бромирования вещества Б в присутствии катализатора АlВr3 образуется В изомерных монобромпроизводных (Г, Д и Е), аналогичная реакция с В дает один продукт Ж. Определите структурные формулы веществ А—Ж, составьте уравнения соответствующих реакций, если известно, что при реакции Кучерова из вещества А получается ацетон.