Настольная книга учителя химии 10 класс - поурочные разработки
СПОСОБЫ ПОЛУЧЕНИЯ И ХИМИЧЕСКИЕ СВОЙСТВА АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ - УГЛЕВОДОРОДЫ
Цели урока. Познакомить учащихся с основными лабораторными и промышленными способами получения аренов и, в первую очередь, бензола. Рассмотреть химические свойства аренов: реакции замещения, присоединения и окисления,— в свете развития представлений о типах и механизмах химических реакций в органической химии. На примере толуола рассмотреть взаимное влияние атомов в молекуле.
Оборудование: бензол (толуол), раствор КМnO4.
I. Получение аренов
Все способы получения и выделения бензола и его производных можно условно разделить на две группы: бензольное кольцо существует или образуется в ходе синтеза.
Важнейшими природными источниками ароматических углеводородов являются продукты коксования (нагревания без доступа воздуха) каменного угля (каменноугольная смола и газы коксования) и нефть. Именно из каменноугольной смолы Глаубер впервые выделил бензол. Бензол Фарадея — это также продукт термической обработки природных веществ. Получение бензола Митчерлихом — это декарбоксилирование бензойной кислоты:
Первый синтез бензола из вещества, не содержащего ароматического кольца, ребятам уже известен. Кто вспомнит эту реакцию? В 1866 г. М. Бертло, пропуская ацетилен через нагретую железную трубку, впервые осуществил синтез бензола:
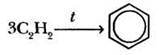
Открытие Н. Д. Зелинским катализатора этой реакции — углерода — увековечено в названии процесса: реакция Зелинского.
Основным промышленным способом получения аренов является дегидрирование углеводородов нефти. Предельные углеводороды от гексана и далее, а также циклогексан и его алкилзамещенные производные при пропускании над нагретым до 300 °С платиновым катализатором дегидрируются, причем для углеводородов с открытой цепью происходит замыкание шестичяенного цикла:
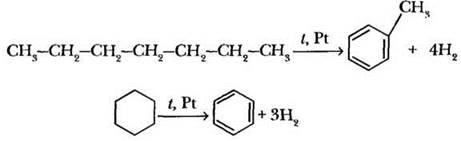
В качестве катализатора можно использовать более дешевый оксид хрома (III). Таким способом получают низшие представители аренов: бензол, толуол, ксилолы.
Гомологи бензола синтезируют введением в ароматическое кольцо алкильного заместителя. Учитель уточняет, что подробнее эта реакция будет рассмотрена при изучении химических свойств бензола.
![]()
II. Химические свойства бензола
Особенности строения молекулы бензола существенно сказываются на его свойствах. Прежде чем перейти к фактическому материалу, учитель проговаривает с ребятами ожидаемые и действительные свойства бензола, проводя параллель между различными классами углеводородов.
Является ли бензол непредельным соединением? Формально да, поскольку содержит на 8 атомов водорода меньше, чем предельный углеводород с шестью углеродными атомами. Но качественная реакция на кратную связь не дает положительного результата. (С помощью каких качественных реакций можно обнаружить двойную или тройную связь? Какие классы углеводородов дают эту реакцию?) Учитель демонстрирует, что при добавлении 1-2 мл бензола к такому же объему раствора перманганата калия обесцвечивания не происходит. Кроме того, бензол в отличие от алкенов очень неохотно вступает в реакции присоединения. Из-за такого химического поведения бензол и его гомологи не принято называть непредельными соединениями. А вот к реакциям замещения бензол, напротив, весьма склонен. Какой класс углеводородов обладает похожим свойством? Конечно, алканы. Но и реакции замещения у бензола протекают специфично. Такая совокупность необычных химических свойств бензола, а также родственных ему соединений, называется ароматическим характером.
Систематизировать изучаемый материал поможет схема, представленная на рисунке 18.
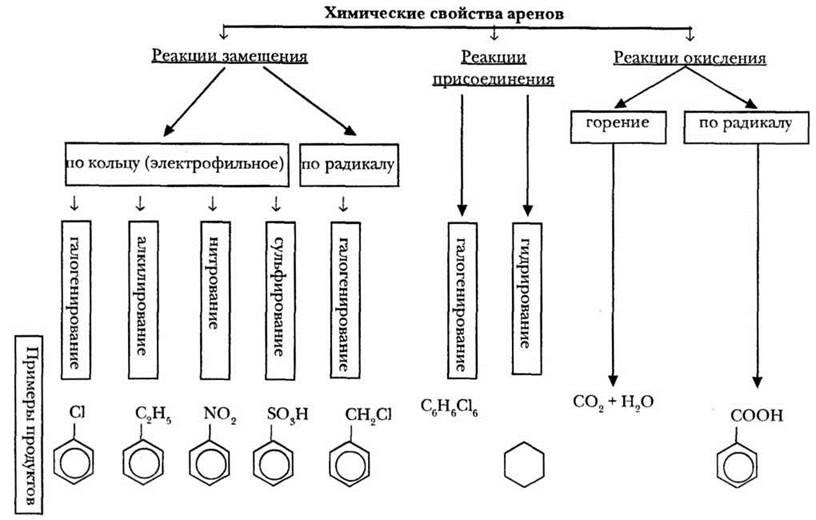
Рис. 18. Химические свойства ароматических углеводородов
Реакции электрофильного замещения
Для учащихся, дальнейшие планы которых никак не связаны с нашей замечательной наукой, термин «электрофильное», равно как и механизм реакции, можно не упоминать вообще. Ребята профильных классов в зависимости от уровня подготовки данный материал могут осилить (в вузе он им понадобится). Поэтому мы сочли уместным привести его в учебнике и прокомментировать в данном пособии.
Поскольку бензольное кольцо насыщено электронами, атакующей его частице нужно иметь дефицит электронной плотности, т. е. частичный или полный положительный заряд. Такая частица, как известно, называется электрофильной, «любящей электроны». Отсюда название механизма замещения — электрофильное.
Замещение в алканах происходит по иному механизму и в иных условиях. С помощью учителя ребята вспоминают, что это радикальные процессы.
Механизм реакции электрофильного замещения аренов можно представить следующим образом:
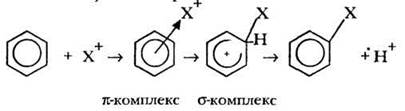
На первой стадии электрофильная частица X+ притягивается к π-электронному облаку и образует с молекулой арена так называемый π-комплекс. Затем два из шести π-электронов ароматического сопряжения образуют σ-связь между X_ и одним из атомов углерода цикла. При этом ароматичность системы нарушаются, т. к. в кольце остается только четыре p-электрона. Образующаяся промежуточная частица называется c-комплекс. Для восстановления ароматичности σ-комплекс выталкивает протон, а два электрона связи С—Н переходят в сопряжение кольца, восстанавливают его ароматичность.
Важнейшими реакциями электрофильного замещения аренов являются галогенирование, алкилирование, нитрование, сульфирование.
1. Галогенирование. Бензол и его гомологи взаимодействуют с хлором и бромом с образованием моногалогензамещенных производных. Учителю придется немного дольше задержаться на этой реакции, чтобы предупредить последующие ошибки учащихся в записи ее уравнения. Таких ошибок может быть несколько.
— Поскольку в молекуле бензола не показаны водородные атомы, в качестве единственного продукта реакций ребята пишут хлорбензол, а также затрудняются назвать тип реакции.
— В качестве побочного продукта часто называют водород.
— В молекуле хлорбензола не изображают ароматическое сопряжение.
— Ребята часто теряются, у какого из атомов углерода продукта записать хлор.
Есть смысл в первой записи уравнения этой реакции изобразить все атомы водорода бензола; оговорившись, что в дальнейшем этого делать не стоит. Учитель показывает, как происходит формальное «удаление» хлороводорода от двух реагирующих молекул. Поскольку все атомы водорода в бензоле (но не у гомологов!) эквивалентны, одинаковы, не имеет значения, какой из них замещать на хлор. В продукте реакции хлор также можно изображать у любого понравившегося атома углерода. В неорганической химии такую реакцию отнесли бы к реакциям обмена. В органике дело обстоит иначе. Тип процесса определяется «с точки зрения» главного вещества реакции, субстрата. В данном случае это бензол. Чем отличается продукт от исходной молекулы бензола? Вместо одного атома водорода он содержит хлор. Это реакция замещения!
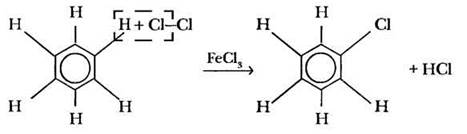
Реакция протекает в присутствии катализаторов — безводных галогенидов алюминия, железа (III) или цинка. Роль катализатора сводится к поляризации неполярной связи Cl—Сl с образованием электрофильной частицы, атакующей электронную плотность бензольного кольца:
![]()
2. Алкилирование. Совершенно аналогично происходит замещение атома водорода в бензольном кольце на алкильный радикал под действием галогеналканов. Впервые эту реакцию в 1877 г. осуществили француз Шарль Фридель и американский химик Джеймс Мейсон Крафте, работая совместно в Парижском университете. Реакция приобрела огромное значение в органической химии и в честь своих первооткрывателей была названа реакцией Фриделя—Крафтса. Заодно так стали называть и катализаторы, перечисленные выше.

Еще одним удобным алкилирующим реагентом являются алкены. Реакция осуществляется в присутствии катализатора Аl2О5. Алкилирование бензола этиленом приводит к образованию этилбензола. Эта реакция используется для получения стирола и далее — полистирола (например, из этой пластмассы, указывает учитель, сделан стаканчик для йогурта) и бутадиен-стирольных каучуков. Использование в качестве реагента пропена позволяет получить еще один важный полупродукт органического синтеза — изопропилбензол (кумол). Учитель должен обязательно обратить внимание на эту реакцию, поскольку кумол — сырье для получения фенола и ацетона. Сложность реакции в том, что сочетание ароматического кольца и алкена происходит по центральному атому последнего.
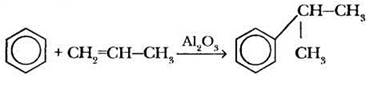
Дотошные ребята иногда спрашивают: это тоже реакция замещения? Не присоединение ли это? Нет, и это еще раз доказывает, что отнесение к тому или иному типу реакции в органической химии проводится по ее механизму.
3. Нитрование. Замещение атома водорода в бензольном кольце происходит под действием смеси концентрированных азотной и серной кислот, называемой нитрующей смесью. Здесь также нередки проблемы: нитрогруппу вместо —NO2 ребята изображают —NO3. Чтобы предупредить ошибку этого рода, учитель обращает внимание ребят на то, что HNO3 — одноосновная кислота, т. е. содержит одну гидроксогруппу ОН, а потому может быть записана с помощью формулы HO-NO2.
Учитель показывает, как от двух исходных веществ отщепляется молекула воды:
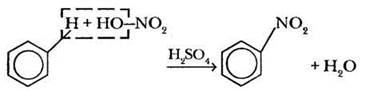
Роль концентрированной серной кислоты также сводится к генерированию электрофильной частицы — так называемого катиона нитрония:
![]()
Эксперимент по нитрованию аренов несложен, при отсутствии бензола или толуола в школьной лаборатории их можно с успехом заменить растворителем под названием «Сольвент», который продается в хозяйственных магазинах. Он содержит более 50% ароматических углеводородов. В пробирку наливают 1-2 мл арена или сольвента, осторожно добавляют 2 мл смеси концентрированных азотной и серной кислот. После встряхивания и разделения гетерогенной смеси верхний органический слой приобретает желтую окраску. Осторожно! Опыт проводить в вытяжном шкафу! Характерный косточковый запах нитробензола лучше описать словами.
4. Сульфирование. Под действием концентрированной серной кислоты происходит замещение атома водорода на сульфогруппу — SO3H, представляющую собой остаток серной кислоты без одной гидроксогруппы:
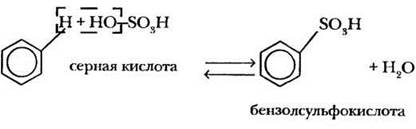
Следует отметить, что реакция сульфирования в отличие от других реакций электрофильного замещения является обратимой. Учитель сам решает, надо ли давать учащимся реакцию сульфирования. В органической химии все взаимосвязано: ведь через несколько уроков придется говорить о способах получения фенола, бензолсульфокислоту придется упоминать.
Реакции присоединения.
Учитель напоминает, что реакции присоединения к бензолу протекают с трудом, в жестких условиях. Это связано с высокой устойчивостью ароматической системы, которая в реакциях этого типа разрушается.
1. Гидрирование. Присоединение водорода к бензолу и его гомологам происходит при повышенной температуре, давлении, в присутствии катализаторов гидрирования (Ni, Pt, Pd):
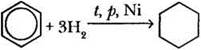
Впервые мелкораздробленные металлы в качестве катализаторов гидрирования предложил использовать в 1901 г. французский химик Поль Сабатье. Это открытие было оценено по достоинству:
П. Сабатье — лауреат Нобелевской премии (1912 г.). Путь от научного открытия до его использования на благо человечества бывает очень недолог. Каталитическое гидрирование — основа маргариновой промышленности, родившейся в начале века. Но об этом — чуть позже.
2. Радикальное галогенирование. При облучении УФ-светом смеси паров бензола с хлором происходит присоединение трёх молекул галогена с образованием гексахлорциклогексана (гексахлорана), который еще недавно широко использовался в сельском хозяйстве для борьбы с саранчой и клещами, однако из-за отрицательного воздействия на окружающую среду был исключен из списка применяемых в сельском хозяйстве пестицидов:
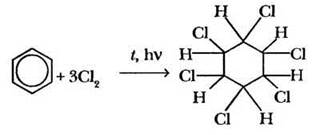
Такая реакция характерна только для бензола. На особенностях химических свойств его гомологов следует остановиться особо.
Осталось записать уравнение еще одной реакции, характерной для большинства органических соединений. Это реакция горения. Бензол на воздухе горит коптящим пламенем ввиду высокого содержания углерода. Напрашивается аналогия с ацетиленом. Кстати, глядя на формулы этих веществ (С6Н6 и С2Н2), математически «подкованные» ребята могут утверждать, что массовые доли элементов у них равны.
![]()
Эта реакция используется в двигателях внутреннего сгорания, ведь бензол — это ценная добавка к моторному топливу.
III. Особенности химических свойств гомологов бензола
Атомы углерода и водорода в бензоле перестают быть неразличимы после того, как в кольце появился первый заместитель. Свойства гомологов бензола (и первого из них — толуола) — яркий пример взаимного влияния атомов в молекуле органического вещества. Учитель увязывает данный этап занятия с теорией строения А. М. Бутлерова, а также развивает первые представления об электронных эффектах, полученные ребятами на первых уроках.
Тот факт, что первый заместитель в ароматическом кольце влияет на направление электрофильной реакции для второго заместителя, стал известен в 70-х гг. XIX в. Это открытие стало еще одним подтверждением справедливости теории строения органических соединений, констатировавшей взаимное влияние атомов и групп атомов в молекулах. В качестве примера учитель предлагает рассмотреть свойства ближайшего гомолога бензола — метилбензола (толуола). В чем же заключается такое влияние?
1. Электрофильное замещение в толуоле (и других алкилбензолах) алкилбензолах протекает легче, чем для незамещенного бензола. Это объясняется смещением электронной плотности связи С—Н метильной группы от водорода к углероду ввиду его большей электроотрицательности. В свою очередь алкильный заместитель увеличивает общую электронную плотность на кольце, облегчая атаку электрофильного реагента.
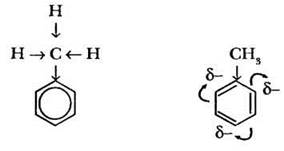
Учитель напоминает ребятам, что такой электронный эффект, который передается от одного атома к другому по σ-связям, называется индуктивным. Говорят, что метальная группа обладает положительным индуктивным эффектом. Например, при нитровании толуола легко образуется не моно-, а тринитротолуол.
2. Алкильный заместитель не только активирует ядро, но и направляет вновь входящий заместитель в орто- и пара-положения цикла. Формально этот процесс можно изобразить схемой, иллюстрирующей сосредоточение электронной плотности (δ-) во 2- и 4-м положениях цикла. Заместители такого типа называются ориентантами первого рода.
Например, при хлорировании толуола в присутствии катализатора Фриделя—Крафтса образуется смесь примерно равных количеств орто-хлортолуола и пара-хлортолуола:
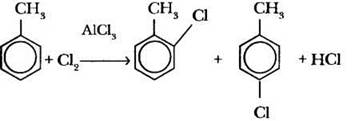
Ребята обычно уравнивают запись этой реакции, что в данном случае не обязательно.
Уже упомянутое выше нитрование толуола может привести к образованию 2,4,6-тринитротолуола, называемого тротилом.
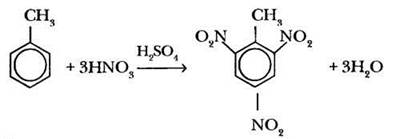
Влияет ли в свою очередь бензольное кольцо на алкильный радикал, связанный с ним? Такое влияние можно подтвердить двумя фактами.
1. Толуол, а также его гомологи с более длинным алкильным радикалом в условиях радикального замещения галогенируются только по α-углеродному атому (то есть ближнему к кольцу) боковой цепи независимо от ее длины:
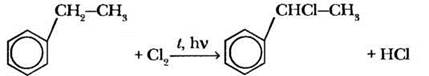
В случае достаточного количества хлора замещению подвергается второй атом водорода в α-положении.
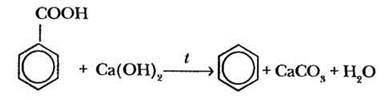
2. Как уже было сказано, ароматическое кольцо устойчиво к действию окислителей. Бензол при обычных условиях не окисляется кислородом воздуха, не обесцвечивает раствор КМnO4. Гомологи же бензола окисляются при нагревании водным раствором перманганата калия. Ароматическое кольцо при этом не затрагивается, окисление идет по сс-углеродному атому боковой цепи. Независимо от ее длины в качестве основного продукта образуется бензойная кислота.
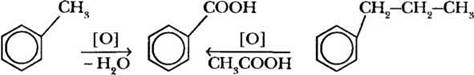
Учитель демонстрирует обесцвечивание раствора перманганата калия с использованием того же сольвента. В пробирке смешивают равные объемы растворителя и раствора КМnO4. Смесь нагревают на горячей водяной бане (избегать открытого огня!). Через 1-2 мин. содержимое пробирки обесцветится.
Для закрепления материала помимо традиционных заданий учитель может предложить ребятам очень полезное упражнение: дописать не правые, а воспроизвести левые части уравнения химических реакций. Обычно это оговаривают так: «Найдена правая половина страницы, разорванной вдоль. Восстановите ее левую половину».
Задание 1
1-й уровень
Напишите формулы и названия алкана и циклоалкана, которые при дегидрировании образуют толуол. Составьте соответствующие уравнения реакций.
2-й уровень
Запишите уравнения реакций, с помощью которых можно осуществить цепочку превращений. При необходимости укажите условия протекания реакций.
карбид кальция → ацетилен → бензол → изопропилбензол
Задание 2
1-й уровень
При пропускании 6,72 л ацетилена (н. у.) над раскаленным углем в качестве катализатора образуется вещество, горящее коптящим пламенем. Какое это вещество? Какова его масса, если выход продукта реакции составляет 75%.
2-й уровень
Какую массу бензолсульфокислоты можно получить при действии на бензол раствора серной кислоты объемом 150 мл с массовой долей H2SO4 95% (плотность раствора 1,83 г/мл)?
Задание 3
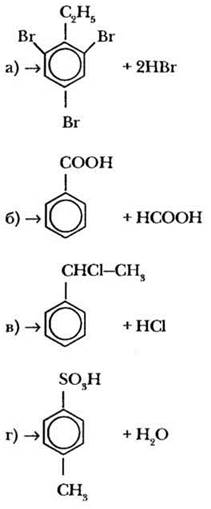
Восстановите левые части уравнений реакций.
1-й уровень
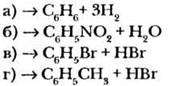
2-й уровень