Настольная книга учителя химии 10 класс - поурочные разработки
ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ - КИСЛОРОДОСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
Цели урока. На основе анализа строения молекул спиртов спрогнозировать их свойства, которые затем рассмотреть в плане общего (характерные свойства спиртов), особенного (свойства многоатомных спиртов). Доказать верность прогнозов в ходе выполнения химического эксперимента.
Оборудование: этанол, изопропанол (или жидкость для растяжки обуви ИПС), изомерные бутиловые спирты, натрий, КВr, KMnO4, H2SO4 (конц. и 15%-ный раствор), растворы K2Cr2O7(5%), CuSO4, NaOH, медная проволока, автомобильный антифриз (тосол), глицерин.
I. Общая характеристика реакционной способности спиртов
Достаточно серьезная вводная часть курса органической химии позволяет учителю совместно с учащимися прогнозировать основные реакционные центры и химические свойства органических веществ, содержащих различные функциональные группы. Однако такое углубление оправданно только в классах профильного типа. В общеобразовательном классе учитель может сразу обратиться к схеме, обобщающей химические свойства предельных одноатомных спиртов (рис. 20). Дальнейшее изложение материала, сопровождающееся демонстрационным экспериментом, удобно проводить в соответствии с этой примерной схемой.
![]()
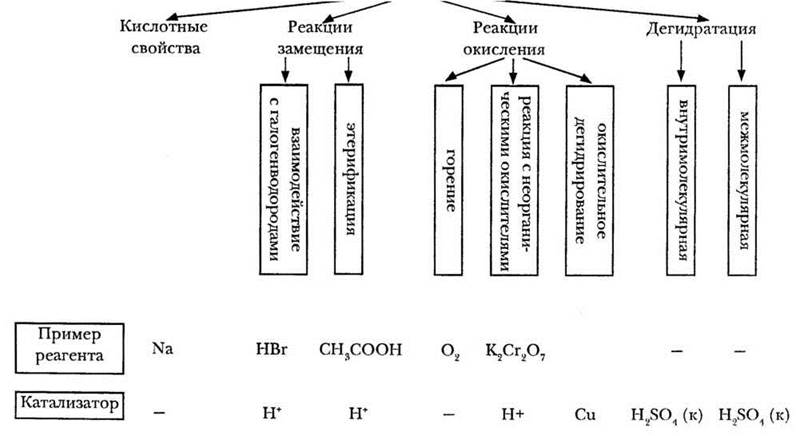
Рис. 20. Химические свойства предельных одноатомных спиртов
Проверку домашнего задания в профильном классе учитель заканчивает вопросом об электронном строении спиртов. Анализируя распределение электронной плотности вблизи функциональной группы, учащиеся с помощью учителя находят наиболее реакционно-способные атомы, определяют тип реакции с их участием и указывают химические связи, которые при этом будут разрываться.
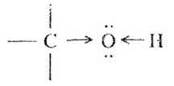
Атом кислорода наиболее электроотрицателен по сравнению с углеродом и водородом, поэтому связи С—О и О—Н — ковалентные полярные. Более полярна связь в гидроксильной группе, при химических реакциях она может гетеролигически разрываться с образованием катиона водорода. Это обусловливает кислотные свойства спиртов. Атом углерода, связанный с гидроксильной группой, имеет дефицит электронной плотности, следовательно, он может быть объектом атаки нуклеофильным реагентом. При этом разрываться будет связь С—О, тип реакции — нуклеофильное замещение. В свою очередь атом кислорода обладает избыточной электронной плотностью, т. к. несет две неподеленные пары электронов. Он придает спирту нуклеофильные свойства, т. е. молекула может выполнять роль реагента в реакциях нуклеофильного замещения. После такого анализа учитель переходит к рассмотрению химических свойств спиртов, и ребята убеждаются, что их теоретический прогноз оказался верным.
II. Химические свойства предельных одноатомных спиртов
1. Кислотные свойства. Проводя аналогию с неорганической химией, учитель пишет на доске несколько структурных формул гидроксилсодержащих соединений:
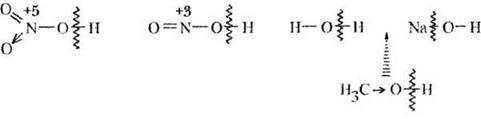
Как видно из рисунка, такие вещества могут проявлять кислотные свойства (азотная и азотистая кислота), основные (гидроксид натрия) или амфотерные (вода). От чего это зависит? От природы и степени окисления атома, связанного с гидроксильной группой. Чем выше электроотрицательность и степень окисления этого атома, тем полярнее связь О—Н, тем сильнее кислотные свойства вещества.
С гидроксильной группой в спиртах связан атом неметалла — углерода, они должны проявлять свойства слабой кислоты. Но из-за положительного индуктивного эффекта алкильного радикала эти свойства настолько слабы, что спирты являются более слабыми кислотами, чем вода!
Сравнение кислотных свойств воды и этанола учитель показывает на демонстрационном эксперименте. Для этого используется два кусочка натрия размером со спичечную головку и две чашки Петри с несколькими миллилитрами воды и этанола. Если заменить этанол изопропиловым спиртом, различие в скорости реакции будет еще заметнее. В хозяйственных магазинах бывает в продаже «Жидкость для растяжки обуви ИПС», представляющая собой практически чистый изопропанол. Он пригодится учителю в школьной лаборатории.
Спирт — настолько слабая кислота, что не вызывает изменения окраски индикатора и не реагирует со щелочами. Напротив, вода, как более сильная кислота, вытесняет спирт из алкоголятов металлов, то есть равновесие реакции гидролиза этилата натрия полностью смещено вправо:
![]()
С увеличением длины углеводородного радикала кислотные свойства спиртов понижаются еще сильнее. Октиловый спирт настолько спокойно реагирует с калием, что в лабораториях его применяют для уничтожения остатков этого металла.
Увеличение числа алкильных заместителей при атоме углерода, связанном с гидроксилом, приводит к тому, что легкость разрыва связи О—Н ослабевает в ряду: первичный > вторичный > третичный спирт. В том же направлении усиливается и способность к разрыву связи С—О.
2. Реакции замещения. Второе химическое свойство спиртов — реакции нуклеофильного замещения. Причем в реакциях с галогеноводородами спирты рассматриваются как субстраты, главные исходные вещества, а в реакции этерификации — как реагенты.
На примере обратимой реакции этилового спирта с бромоводородом учитель закрепляет материал по химическому равновесию.
![]()
Учащиеся отвечают на вопрос, какие факторы влияют на положение равновесия: температура, давление, концентрация реагентов. Данная реакция в лабораторных условиях проводится при атмосферном давлении, и ее тепловой эффект незначителен. Сместить равновесие в нужном направлении можно, главным образом, путем изменения концентрации веществ. В каком направлении будет смещаться равновесие при избытке кислоты? В сторону образования галогеналкана. Реакцию проводят в присутствии концентрированной серной кислоты. Она выполняет сразу четыре функции: является катализатором (активирует молекулу спирта); создает кислотную среду, способствующую смещению равновесия вправо; будучи сильным водоотнимающим средством, прочно связывает молекулы воды; генерирует реагент. Последняя функция связана с тем, что галогеноводороды являются газообразными веществами, их получают непосредственно в ходе реакции по уравнению:
![]()
Смещения равновесия вправо добиваются также удалением из сферы реакции продукта — бромэтана. Будучи легколетучим веществом, он выделяется в виде газа и затем конденсируется в холодильнике.
Можно ли сместить равновесие реакции влево? Если процесс проводить в щелочной среде, то галогеноводород будет образовывать соль, бромэтан гидролизуется в этиловый спирт. Можно ли извлечь выгоду из этого процесса? Конечно, так в промышленности получают многие спирты.
Реакцию получения бромистого этила учитель может продемонстрировать на заседании химического кружка или факультативном занятии. Для этого потребуется установка для перегонки жидкостей с нисходящим холодильником (рис. 21).
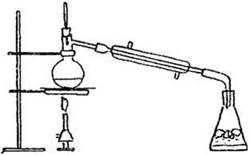
Рис. 21. Установка для получения бромэтана
В колбу Вюрца наливают 7 мл этилового спирта, добавляют б мл воды и при перемешивании и охлаждении постепенно вливают 12 мл концентрированной серной кислоты. Смесь охлаждают до комнатной температуры и при перемешивании добавляют мелко растертый КВr (13,5 г). В приемную колбу наливают 30 мл воды с кусочками льда. Реакционную смесь нагревают на песчаной бане, пока в приемник не перестанут поступать маслянистые капли бромистого этила.
Каталитическая роль серной кислоты в данной реакции рассмотрена в учебнике. Она сводится к протонированию атома кислорода гидроксильной группы с образованием катиона алкилоксония. Эта промежуточная очень активная частица гораздо легче реагирует с нуклеофилом (бромид-анионом), образуя конечный продукт и воду:
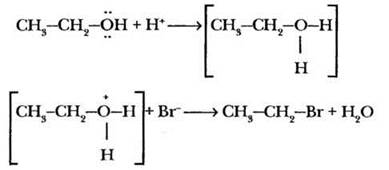
Однако у бромид-аниона в реакционной смеси есть конкурент — гидросульфат-анион. Этот нуклеофил также может реагировать с катионом этилоксония с образованием продукта замещения атома водорода в неорганической кислоте на углеводородный радикал. Такие вещества называются сложными эфирами. В данном случае образуется этиловый эфир серной кислоты — этилсульфат:
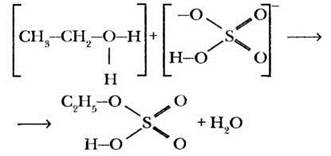
Могут ли спирты образовывать сложные эфиры с органическими кислотами? Это и есть вторая рассматриваемая реакция нуклеофильного замещения — реакция этерификации.
Одна из важнейших реакций спиртов — взаимодействие с карбоновыми кислотами. В результате образуются производные карбоновых кислот, которые можно формально рассматривать как продукты замещения атома водорода карбоксильной группы на углеводородный радикал. Такие вещества называются сложными эфирами, а процесс их получения — реакцией этерификации. Химиками абсолютно точно доказано, что при образовании сложного эфира от молекулы спирта отщепляется атом водорода, а от кислоты — гидроксогруппа:
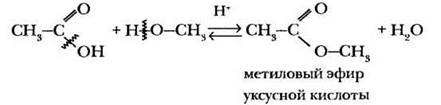
Реакции этерификации протекают в присутствии сильных кислот в качестве катализатора и являются обратимыми. В теме «Спирты» учитель может не вдаваться в подробности механизма реакции, сэкономить время на демонстрационном эксперименте и объяснении номенклатуры сложных эфиров. Урок и без этого достаточно насыщен, а при изучении карбоновых кислот на реакции этерификации можно будет остановиться подробнее.
3. Реакции окисления спиртов. Кислородсодержащие органические вещества, как и углеводороды, горят на воздухе или в кислороде с образованием паров воды и углекислого газа. 1орение спиртов — сильно экзотермическая реакция. При полном окислении 1 моль этилового спирта выделяется 1370 кДж тепла.
![]()
Экзотермичность горения спиртов позволяет рассматривать их в качестве альтернативного бензину экологически чистого топлива для двигателей внутреннего сгорания.
Далее напрашивается демонстрационный эксперимент — горение этилового спирта. Что может быть проще? И вместе с тем безынтереснее... А ведь что стоит «украсить» опыт — изменить словесное и демонстрационное оформление. Учитель говорит, что спирты относятся к группе легко воспламеняющихся веществ (ЛВЖ). Если в лаборатории есть стандартная бутылка с каким-либо спиртом, ребятам демонстрируется соответствующий знак на этикетке. Такие вещества могут воспламеняться не только от открытого огня, но и при контакте с сильными окислителями. Поэтому хранят их отдельно в металлическом шкафу. Учитель готовит окислительную смесь из кристаллического перманганата калия (на кончике шпателя) с добавлением 2-3 капель концентрированной серной кислоты. Затем касается стеклянной палочкой («волшебной»!) окислительной смеси и ватки, смоченной этиловым спиртом. Спирт мгновенно вспыхивает и горит бледно-голубым, практически бесцветным пламенем.
Что нужно сделать, чтобы пламя спирта было заметнее? Верно, затемнить помещение. Если это возможно, учитель показывает весьма эффектный кулинарный изыск: кофе «Огонек». Только что сваренный кофе разлить из турки в две чашечки на подносе. В столовую ложку налить этиловый спирт, поджечь и осторожно вылить в чашку кофе. То же самое проделать со второй чашкой. Пары спирта, выделяясь из горячего кофе, будут гореть секунд 30-40. В таком виде кофе и подают на стол. Привкуса спирта в нем не чувствуется, но лучше все-таки допить его взрослым.
В профильном классе учитель уже упоминал, что алкогольные напитки весьма калорийны. При метаболизме этанола в организме выделяется примерно 770 кДж/моль энергии, а это значит, что окисляется он не до углекислого газа и воды, а до других кислородсодержащих соединений. Каких? Об этом и пойдет речь далее.
Продемонстрировать окисление первичных и вторичных спиртов до карбонильных соединений учителю помогут два демонстрационных эксперимента.
В пробирку с 4-5 мл этанола вносится медная проволока, свернутая на конце в пружинку и раскаленная в пламени спиртовки. Хорошо видно, что черный слой оксида меди (II) на проволоке исчезает, обнажая блестящую красноватую поверхность чистого металла. После нескольких подобных манипуляций можно почувствовать из пробирки характерный запах уксусного альдегида.
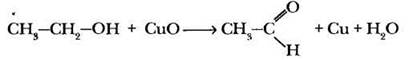
Сущность окисления спиртов до альдегида или кетона сводится к отщеплению двух атомов водорода. Естественно, что такой процесс невозможен для третичных спиртов. Они окисляются в жестких условиях (например, кипячение с подкисленным раствором перманганата калия) с разрывом углерод-углеродной цепочки. Сравнить относительную способность различных спиртов к окислению учитель может с помощью демонстрационного эксперимента. Если спирты различного типа в лаборатории отсутствуют, остается продемонстрировать окисление этанола. Это красивая цветная реакция.
В пробирку налить 1 мл 4-5%-ного раствора бихромата калия и добавить 15%-ный раствор серной кислоты до общего объема 5 мл. Разлить равные объемы окислительной смеси в пробирки по числу имеющихся в лаборатории спиртов. В каждую пробирку добавить по 3 капли исследуемого спирта. Уже при комнатной температуре в пробирке с этанолом цвет раствора постепенно изменяется с оранжевого на зеленый вследствие появления ионов Cr3+. Содержимое остальных пробирок учитель нагревает на пламени горелки до кипения (осторожно, избегать разбрызгивания жидкости!). В пробирке с третичным бутиловым спиртом изменения цвета не наблюдается. В пробирках с первичными и вторичными спиртами (изопропиловым, н-бутиловым, вторичным бутиловым, изобутиловым) появляется зеленое окрашивание, свидетельствующее о протекании реакции окисления при повышенной температуре. Уравнение процесса для этанола выглядит следующим образом:
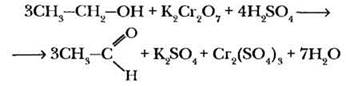
Процесс каталитического дегидрирования спиртов также является окислительным, поскольку степень окисления атома углерода, связанного с гидроксилом, повышается от -1 до +1. Учитель не акцентирует внимание на природе и номенклатуре продуктов реакции окисления и дегидрирования, а только называет продукты и класс образующихся веществ: альдегиды и кетоны.
4. Дегидратация спиртов. Реакции дегидратации спиртов — еще один пример того, какое большое значение в органической химии имеют условия проведения взаимодействия. В данном случае строение основного продукта реакции зависит от температуры процесса. Учитель изображает на доске условные схемы протекания внутри- и межмолекулярной дегидратации этилового спирта:
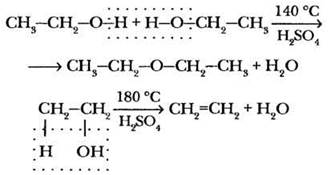
Эта реакция уже демонстрировалась при изучении темы «Алкены», поэтому повторить эксперимент можно только при наличии достаточного количества времени.
Строго говоря, превращение этилового спирта в диэтиловый эфир или этилен — это различные направления разложения этилсульфата, образующегося на первом этапе реакции. При температуре до 140 °С доминирует реакция нуклеофильного замещения этилсульфата с избытком этилового спирта. При большей температуре этилсульфат разлагается на серную кислоту и этилен:
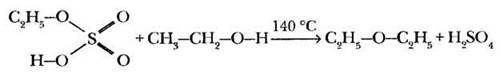
Отщепление молекулы воды от вторичных и третичных спиртов подчиняется правилу Зайцева. Поскольку ученики уже знакомы с этим правилом по теме «Алкены», учитель просит кого-либо из класса написать на доске продукт дегидратации, например пентанола-2.
Для ребят второго уровня подготовки задание можно усложнить, «вывернув наизнанку»: дегидратацией какого спирта можно получить 3-метилбутен-1? Ответ однозначен — 3-метилбутанол-1.
5. Особенности химических свойств многоатомных и непредельных спиртов
Многоатомными спиртами называются органические соединения, в молекулах которых содержится две или более гидроксильные группы. Их можно рассматривать как производные предельных углеводородов, в которых несколько атомов водорода замещены на группы —ОН. В зависимости от числа гидроксильных групп в молекуле различают двухатомные, трехатомные и многоатомные спирты. Следует обратить внимание ребят на то, что соединения, содержащие у одного углеродного атома две или более гидроксильные группы, крайне неустойчивы и при обычных условиях не существуют.
Основой названия многоатомных спиртов служит название предельного углеводорода с тем же числом углеродных атомов. После основы с суффиксами -диол, -триол и т. д. указывается число гидроксильных групп и цифрами — их положение в углеродной цепи. Для простейших многоатомных спиртов распространены тривиальные названия и заместительная номенклатура:
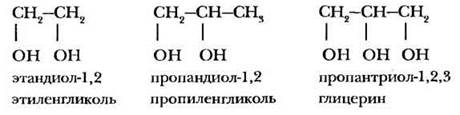
Глицерин открыл выдающийся шведский химик Карл Шееле в 1779 г. Нагревая оливковое масло с кислотой, он выделил маслянистую жидкость, сладкую на вкус. Новое вещество получило название глицерин (от греческого glykeros - сладкий).
В 1846 г. итальянский химик Асканьо Собреро нагрел глицерин со смесью серной и азотной кислот. Полученный продукт при попытке его выделения взорвался с огромной силой. Так был открыт сложный эфир глицерина и азотной кислоты — тринитрат глицерина (нитроглицерин).
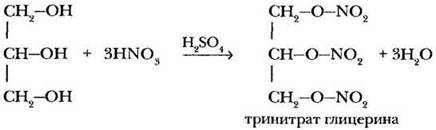
Естественно, новое вещество пробовали применять в военных целях. Однако капризная взрывчатка часто взрывалась раньше, чем это требовалось: при транспортировке, от сотрясения и удара. Укротить тринитрат глицерина удалось шведскому инженеру-химику, изобретателю и промышленнику Альфреду Нобелю.
Немногие знают, что значительную часть жизни Нобель прожил в России. Именно здесь он работал директором завода по производству нитроглицерина. Частые несчастные случаи на заводе подвигли Нобеля к поиску мегодов безопасного обращения с этим веществом. В 1866 г. после многочисленных экспериментов ученый обнаружил, что пропитанная нитроглицерином инфузорная земля (кизельгур) безопасна при хранении и транспортировке, но сохраняет свои взрывчатые свойства. Так был изобретен динамит. Человечество с благодарностью вспоминает о Нобеле не только как основателе знаменитой премии, но и изобретателе динамита. Его разрушительная сила используется во благо — при прокладке туннелей, поиске и добычи полезных ископаемых, в строительстве.
Учитель демонстрирует учащимся глицерин и характеризует его физические свойства. Показывая растворимость глицерина в воде, учитель готовит раствор для следующего опыта.
Качественной реакцией на многоатомные спирты, содержащие гидроксильные группы у соседних атомов углерода, является их взаимодействие со свежеосажденным гидроксидом меди (II):
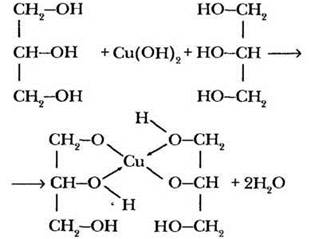
Ярко-синее окрашивание раствора в результате образования комплексного соединения глицерата меди (II) свидетельствует о присутствии в растворе многоатомного спирта. Полученный раствор учитель оставляет до следующего занятия, посвященного применению спиртов.
Непредельные спирты, имеющие в углеводородном радикале кратную углерод-углеродную связь, сохраняют как свойства спиртов, так и свойства олефинов. Они, например, обесцвечивают бромную воду в результате реакции присоединения:
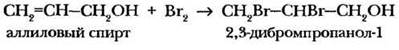
Задание 1. Составьте уравнения реакций, с помощью которых можно осуществить цепочку превращений. При необходимости укажите условия протекания реакций.
1-й уровень
![]()
б) пропанол-1 пропен → пропанол-2 → пропанон-2
2-й уровень
а) пропанол-1 → X → Y → 2,3-диметилбутан
![]()
Задание 2
1-й уровень
С какими из перечисленных веществ может реагировать метиловый спирт: калий, оксид натрия, вода, оксид меди (II), уксусная кислота, этилен. Напишите уравнения возможных реакций и укажите условия их протекания.
2-й уровень
При окислении этилена водным раствором перманганата калия получили органическое вещество А. Оно растворяет гидроксид меди (II) с образованием комплексного соединения Б ярко-синего цвета. Обработка вещества А нитрующей смесью приводит к получению продукта В, являющегося мощным взрывчатым веществом. Напишите уравнения всех упомянутых реакций, назовите вещества А — В.
Задание 3
1-й уровень
Какое органическое вещество получится при взаимодействии 12 г пропанола-2 с избытком бромоводорода? Какова масса этого вещества, если выход продукта реакции составляет 80% от теоретически возможного?
2-й уровень
Разложение тринитрата глицерина при взрыве сопровождается выделением большого количества энергии и огромного объема газообразных веществ. По термохимическому уравнению
![]()
рассчитать, какое количество теплоты выделится при взрыве 1 кг вещества? Какой объем газообразных веществ, приведенный к нормальным условиям, при этом получится?