Настольная книга учителя химии 10 класс - поурочные разработки
СПОСОБЫ ПОЛУЧЕНИЯ СПИРТОВ. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ - КИСЛОРОДОСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
Цели урока. Рассмотреть общие способы получения спиртов и особенные — для метанола, этанола, этиленгликоля и глицерина. Познакомить учащихся с этими представителями спиртов и рассмотреть их значение для химической промышленности и повседневной жизни человека.
Оборудование: К2Сr2О7 этанол, растворы NaOH (10%-ный), KI, кристаллы йода, кефир или молочная сыворотка, автомобильный антифриз (тосол).
I. Способы получения спиртов
В данном разделе учителю целесообразно представить только общие способы получения спиртов, специфические же методы отнести в раздел, касающийся отдельных представителей.
Задача облегчается тем, что два из трех изучаемых способов синтеза спиртов ребятам уже известны. Проверку домашнего задания по химическим свойствам спиртов учитель может построить таким образом, чтобы завершить ее рассмотрением реакции реакцией алканолов с галогеноводородами, например:
![]()
Какова особенность этой реакции? Она обратима. Нетрудно заметить, что обратная реакция тоже полезна, поскольку как раз и является способом получения спирта. Как же можно сместить равновесие влево с помощью варьирования концентраций веществ? Обычно ребята предлагают увеличивать концентрацию воды или бромэтана. Нельзя говорить, что это неверно! Но есть второй подход. Можно, например, уменьшить концентрацию бромоводорода, превратив его в другое вещество. Какое? Проще всего в соль, подействовав щелочью.
![]()
А теперь объединим две реакции в одну и запишем уравнение в обратном направлении:
![]()
Такую реакцию принято называть щелочным гидролизом галогеналканов. В присутствии щелочи гидролиз практически необратим, поэтому является удобным методом получения спиртов всех типов (первичных, вторичных, третичных, многоатомных, непредельных).
Данная реакция — хороший повод для учителя еще раз обратить внимание учащихся на важность условий проведения реакций в органической химии. Ведь если вести процесс не с водным, а спиртовым раствором щелочи, вместо ожидаемого спирта мы получим алкен! Отсутствие указаний на условие проведения реакции (где это необходимо) — серьезный недочет, приравниваемый к ошибке на вступительных экзаменах в вуз.
Взаимодействие галогеналкана со щелочью протекает по механизму нуклеофильного замещения. Учащиеся профильных классов получают благодатную возможность для отработки терминов: субстрат (галогеналкан), реагент (гидроксид натрия), нуклеофильная частица (гидроксид-анион), уходящая группа (бромид-анион). В субстрате электрофильным (обедненным электронной плотностью) является атом углерода, связанный с электроноакцепторным галогеном. Именно сюда и направляется атака неподеленной электронной пары нуклеофила — группы ОН-. Механизм реакций нуклеофильного замещения подробно изложен в учебнике.
Вторым наиболее общим способом получения спиртов является реакция гидратации алкенов, тоже знакомая ребятам. На примере этой реакции учитель закрепляет правило Марковникова:
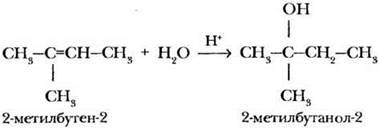
Ребята профильного класса решают проблемный вопрос: какие ограничения у этого способа получения алканолов? В ходе обсуждения проблемы формулируется обобщение: так нельзя получить метанол и любые первичные спирты, кроме этилового.
Последний из общих способов получения предельных спиртов также связан с повторением материала о химических свойствах алканолов. Окисление первичных и вторичных спиртов приводит к получению соответственно альдегидов и кетонов. Оказывается, возможна и обратная реакция. При пропускании паров альдегида или кетона с водородом над никелевым катализатором происходит восстановление карбонильной группы до гидроксильной в результате присоединения молекулы водорода по двойной связи:
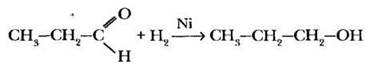
И снова формулируется обобщение: таким способом нельзя получить третичные спирты. Восстановлением альдегидов получают спирты первичные, кетонов — вторичные.
II. Отдельные представители спиртов, их физиологическое действие
1. Метиловый спирт. Как уже говорилось, метиловый спирт открыли Ж. Дюма и Э. Пелиго в 1834 г. Вещество было выделено из продуктов сухой перегонки древесины. Впервые синтезировал метанол М. Бертло в 1858 г. щелочным гидролизом хлорметана:
![]()
В настоящее время метанол в больших количествах получают из синтез-газа — смеси газообразных оксида углерода (II) и водорода:
![]()
Катализатором процесса являются оксиды цинка или хрома.
Необходимо еще раз напомнить детям, что метанол очень ядовит! Он является нервно-сосудистым ядом. При попадании в организм от 5 до 10 мл этого вещества наступает паралич зрения вследствие поражения сетчатки глаз, доза в 30 мл и более вызывает смерть. Однако области промышленного применения метилового спирта очень обширны. Он является прекрасным растворителем, сырьем для получения формальдегида, полимеров, лекарственных препаратов. В ряде стран метанол добавляют в моторное топливо для увеличения октанового числа бензина.
2. Этиловый спирт. Получение этилового спирта — одна из древнейших химических реакций, открытых и используемых человечеством. Мы можем гордиться своими пращурами, поскольку получение этанола из растворов, содержащих углеводы (например, глюкозу), является довольно сложной реакцией. Она протекает в присутствии ферментов — особых веществ природного происхождения, выполняющих роль катализатора.
![]()
Такой процесс называется спиртовым брожением. Так получают этиловый спирт, используемый в медицине и винокурении. Для технических целей этанол получают гидратацией этилена.
Прежде чем клясть алкоголь за его разрушительное действие на психику и здоровье человека, учитель может сообщить ребятам неожиданную для многих информацию.
Небольшие количества этилового спирта содержатся в таких отнюдь не алкогольных продуктах питания, как кефир и молочная сыворотка. Он образуется в результате брожения углевода, содержащегося в молоке — лактозы. Как же обнаружить этанол в этих продуктах? Оказывается, на этиловый спирт есть очень чувствительная качественная реакция, называемая йодоформной.
Учитель демонстрирует следующий эксперимент. В пробирку помещают 0,5 мл фильтрата кефира или сыворотки, добавляют 0,5 мл 10%-ного раствора гидроксида натрия и несколько капель раствора иода в иодиде калия (реактив Люголя). Если содержимое пробирки окрашено, его обесцвечивают добавлением щелочи. При незначительном нагревании раствор мутнеет, можно почувствовать характерный запах трииодметана, называемого йодоформом (по аналогии с хлороформом). Реактив Люголя готовят, растворяя 1 г кристаллического йода и 2 г KI в 10 мл воды.
Йодоформная проба широко используется в органической химии для обнаружения соединений, содержащих фрагмент СН3—СНОН— или продуктов его окисления — ацетальдегида или метилкетонов. Поэтому в классах с углубленным изучением химии учитель может объяснить химизм этой реакции.
На первой стадии происходит окисление этилового спирта до уксусного альдегида:
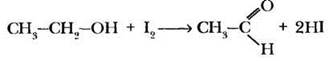
Вторая стадия реакции — замещение атомов водорода метильной группы на атомы йода:
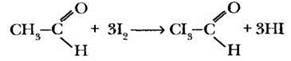
В щелочной среде трииодацетальдегид распадается с образованием йодоформа и формиата натрия:
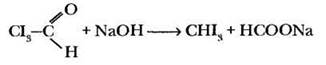
Суммарно все три реакции можно выразить уравнением:
![]()
Учитель спрашивает, почему нельзя готовить реактив Люголя с использованием аптечной йодной настойки? Присутствие в ней этилового спирта будет мешать проведению пробы, давая положительную реакцию.
Этиловый спирт обладает выраженным дезинфицирующим средством, поэтому его широко применяют в медицине. Кроме того, для приготовления настоев и экстрактов используется высокая растворяющая способность этанола.
Алкогольные напитки могут на некоторое время улучшить самочувствие человека. Они помогают ему справиться со стрессом и расслабиться, привести в радостное состояние, снять напряжение, волнение, развеять тоску. Все эти эффекты связаны с одной и той же особенностью поведения этанола в организме человека: он подавляет активность центральной и периферической нервной системы. И тем самым наносит человеку вред, во много раз превосходящий временное улучшение состояния.
Подавление нервной активности под действием алкоголя сопровождается важными кратковременными эффектами: снижается острота зрения, замедляются реакции, речь, уменьшается способность здраво рассуждать. Именно из-за этого во всех странах существует либо полный запрет на употребление алкоголя водителями, либо строгое ограничение дозы.
На факультативном или дополнительном занятии учитель может провести лабораторную работу, имитирующую работу индикаторной трубки «Алкотест», которой пользовались инспекторы ГИБДД.
Учитель готовит три индикаторные трубки, из нижних частей старых разбитых бюреток. Длина трубки 10 см, ее наполняют кристаллическим бихроматом калия, помещенным между двумя ватными тампонами. Необходимо приготовить три водно-спиртовых раствора, добавляя к 100 мл дистиллированной воды 3, 6 и 10 капель чистого этилового спирта. Концентрация среднего раствора примерно соответствует максимально допустимому содержанию алкоголя в крови, разрешенному для водителей в Англии и Германии. Собрать установку, изображенную на рисунке 22. Колбу с раствором спирта средней концентрации помещают в водяную баню, нагреваемую до температуры 40 °С, что примерно соответствует температуре человеческого тела.
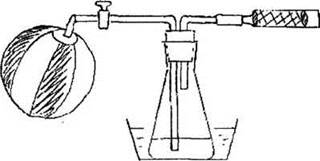
Рис. 22. Схема установки для имитации теста на содержание алкоголя в крови
В качестве источника «выдыхаемого» воздуха можно использовать пляжный пластиковый мяч, накачанный велосипедным насосом, или автомобильную камеру. После нагревания содержимого колбы до нужной температуры к длинной газоотводной трубке присоединяют мяч, открывают кран и медленно пропускают воздух в течение 2 минут. Ближняя к колбе часть индикаторной трубки окрасится в зеленый цвет. Повторяя опыт с двумя другими концентрациями этанола в воде, сравнивают длину окрашенной зоны и делают вывод, что она пропорциональна содержанию спирта.
3. Этандиол-1,2 (этиленгликоль). Этот спирт уже встречался в курсе органической химии, поэтому учитель вправе спросить ребят, какие способы его получения они могли бы предложить. Как правило, они вспоминают реакция Вагнера и щелочной гидролиз 1,2-дигалогенэтана:
![]()
В промышленности же этиленгликоль получают взаимодействием оксида этилена с водой:
![]()
А как получают оксид этилена? Пусть ребята заглянут в тетрадь, главное, чтобы они нашли правильный ответ — каталитическое окисление этилена кислородом в присутствии серебряного катализатора.
Этиленгликоль смешивается с водой в любых соотношениях, причем растворы эти имеют очень низкую температуру замерзания. Например, 53%-ный раствор этиленгликоля кристаллизуется при -40 °С, а 66%-ный раствор — при -60 °С. (Кстати, температура плавления чистого этиленгликоля всего -12 °С). Это свойство используется для изготовления антифризов — незамерзающих жидкостей, используемых для охлаждения двигателей автомобилей в зимних условиях. Этиленгликоль также входит в состав тормозных и гидравлических жидкостей. Учитель демонстрирует ребятам образец автомобильного тосола. Почему он окрашен в ярко-синий цвет? В качестве антикоррозионной добавки антифриз содержит соединения меди, которые и образуют с этиленгликолем комплексное соединение, знакомое по предыдущему уроку.
В гораздо больших количествах этиленгликоль используется для получения полимеров, главным образом полиэтилентерефталата, из которого изготовляют знакомые всем пластиковые бутылки для шипучих напитков и синтетическое волокно лавсан.
4. Пропантриол-1,2,3 (глицерин). В промышленности глицерин помимо гидролиза жиров, о чем пойдет речь далее, получают из пропена.
Схему этого процесса учащимся можно и не давать, однако учитель должен быть «во всеоружии» в случае «коварного» вопроса:
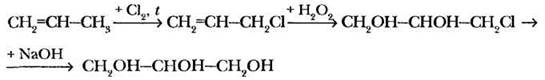
В отличие от этиленгликоля глицерин не ядовит. Помимо многочисленных косметических и парфюмерных изделий, он входит даже в состав кондитерских изделий, напитков. Глицерин очень гигроскопичен. Если оставить вещество в открытом сосуде, его масса увеличивается на 40% за счет поглощения влаги воздуха.
Значительное количество глицерина используется для изготовления взрывчатых веществ, в частности тринитрата глицерина. Несмотря на взрывоопасность этого вещества, в очень малых дозах он применяется в медицине в качестве лекарственного средства при сердечнососудистых заболеваниях.
III. Решение задач на вывод формул органических веществ, содержащих кислород
Если учитель еще не давал учащимся алгоритм решения задач на нахождение формулы органического вещества по продуктам сгорания, то целесообразно объяснить этот тип задач в разделе «Кислородсодержащие соединения».
Алгоритм решения задач на вывод формул органических веществ, содержащих кислород
1. Обозначить формулу вещества с помощью индексов х, у, z и т. д. по числу элементов в молекуле. Если продуктами горения являются СО2 и Н2О, вещество может содержать 3 элемента (СxНyОz). Частные случаи: сжигают углеводород (СxНy); продуктом горения кроме СО2 и Н2О является азот (СxНyОzNm).
2. Составить уравнение реакции горения без коэффициентов.
3. Найти количества веществ продуктов сгорания.
4. Рассчитать количество вещества атомов углерода и водорода.
5. Если не сказано, что сжигаемое вещество — углеводород, рассчитать массы углерода и водорода в продуктах сгорания. Найти массу кислорода в веществе по разности массы исходного вещества и m(С) + m(H). Вычислить количество вещества атомов кислорода.
6. Соотношение индексов х:у:z ... равно соотношению количеств веществ n(С): n(Н): n(О)... приведенному к отношению целых чисел.
7. При необходимости по дополнительным данным в условии задачи привести полученную эмпирическую формулу к истинной.
Пример 1.
При сжигании 0,46 г органического вещества было получено 0,88 г оксида углерода (IV) и 0,54 г воды. Плотность паров вещества по водороду равна 23. Определите его молекулярную формулу.
Дано:
m (в-ва) = 0,46 г
m (СO2) = 0,88 г
m (Н2O) = 0,54 г
Dh2 (в-ва) = 23
Формула — ?
Решение:
1. Обозначим формулу вещества СxНyОz.
2. Составим уравнение реакции горения:
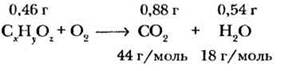
3. Вычислим количества вещества СО2 и Н2О:
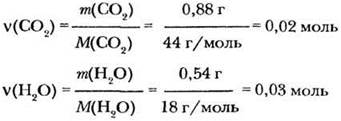
4. Вычислим количества вещества атомов углерода и водорода:
![]() Обратите внимание!
Обратите внимание!
5. Найдем массы углерода и водорода в веществе:
![]()
![]() Обратите внимание!
Обратите внимание!
6. Определим массу кислорода в веществе:
![]()
7. Найдем количество вещества атомов кислорода:
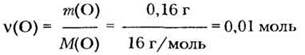 Обратите внимание!
Обратите внимание!
8. Найдем отношение индексов х:у:z:

Эмпирическая формула вещества С2Н6О.
9. По дополнительному условию задачи определим истинную формулу вещества:
Относительная молекулярная масса простейшей формулы
![]()
Истинную относительную молекулярную массу вещества вычисляем по его плотности по водороду:
![]()
Следовательно, найденная эмпирическая формула вещества является истинной.
Ответ. С2Н6O.
Пример 2
При сгорании органического вещества массой 3,9 г, относительная плотность паров которого по воздуху равна 2,69, образовался оксид углерода (IV) объемом 6,72 л (н. у.) и вода массой 2,7 г воды. Какова формула вещества?
Дано:
m(в-ва) = 3,9 г
V(СO2) = 6,72 л
m(Н2O) = 2,7 г
Dвозд(в-ва) = 2,69
Формула — ?
Решение:
1. Обозначим формулу вещества СxНyОz.
2. Составим уравнение реакции горения:
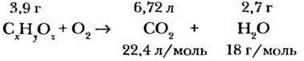
3. Вычислим количества вещества СО2 и Н2О:
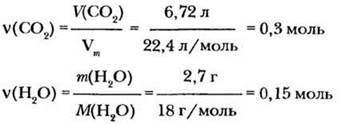
4. Вычислим количества вещества атомов углерода и водорода:
![]()
5. Найдем массы углерода и водорода в веществе:
![]()
6. Определим массу кислорода в веществе:
![]()
Кислорода в веществе нет.
7. Найдем отношение индексов х:у:
![]()
Эмпирическая формула вещества СН.
8. По дополнительному условию задачи определим истинную формулу вещества:
Относительная молекулярная масса простейшей формулы
![]()
Истинную относительную молекулярную массу вещества вычисляем по его плотности по воздуху:
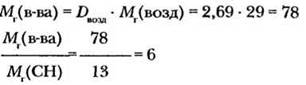
Следовательно, истинная формула вещества C6H6.
Ответ: C6H6.
Задачи для закрепления материала
1-й уровень
1. При сжигании углеводорода образовалось 22,0 г углекислого газа и 4,5 г воды. Определите молекулярную формулу углеводорода, зная, что он содержит 2 атома углерода.
2. При сгорании органического вещества массой 2,3 г образовался оксид углерода (IV) массой 4,4 г и вода массой 2,7 г. Относительная плотность паров этого вещества по воздуху равна 1,59. Определите его структурную формулу, зная, что оно не реагирует с металлическим натрием.
2-й уровень
1. При сжигании 1,8 г органического вещества образовалось 2,016 л оксида углерода (IV) (н. у.) и 2,16 г водяных паров. Напишите структурные формулы и названия всех возможных изомеров этого вещества, если известно, что 1 л его паров при нормальных условиях имеет массу 2,679 г.
2. При полном окислении 0,9 г гомолога этиленгликоля в токе кислорода образовалось 1,76 г оксида углерода (IV) и 0,9 г воды. Определите молекулярную формулу вещества.