Настольная книга учителя химии 10 класс - поурочные разработки
ХИМИЧЕСКИЕ СВОЙСТВА АЛЬДЕГИДОВ И КЕТОНОВ - КИСЛОРОДОСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
Цели урока. На основании строения молекул альдегидов и кетонов спрогнозировать их химические свойства, которые затем рассмотреть в сравнении для обоих классов этих соединений.
Оборудование: йод кристаллический, иодид калия, ацетон; растворы аммиака, нитрата серебра, сульфата меди (II), гидроксида натрия, глюкозы; растворитель 645 или 646; спиртовка, пробирки.
I. Теоретический прогноз реакционной способности альдегидов и кетонов
Объяснение материала учитель начинает с констатации того, что химические свойства альдегидов и кетонов определяются содержанием в молекуле функциональной карбонильной группы. Учащиеся сами формулируют вывод о том, что наличие π-связи предопределяет такой характерный для карбонильных соединений тип реакций, как реакции присоединения.
В профильных классах это утверждение рассматривается глубже. В отличие от кратной углерод-углеродной связи в алкенах двойная связь углерод-кислород сильно полярна. Значительный положительный заряд на атоме углерода предполагает, что присоединяющийся реагент должен иметь нуклеофильный характер. Следовательно, большинство реакций присоединения по карбонильной группе являются реакциями нуклеофильного присоединения. В профильном классе учитель объясняет механизм подобных реакций, приведенный в учебнике. Так присоединяются к альдегидам синильная кислота, гидросульфит натрия, металлорганические соединения (например, реактивы Гриньяра).
Нуклеофильное присоединение является первой стадией второго важнейшего типа реакций альдегидов и кетонов — конденсации. В результате реакций присоединения образуются продукты, содержащие гидроксильную группу. Если фрагмент нуклеофила Nu имеет подвижный атом водорода в a-положении к реакционному центру, возможно отщепление молекулы воды с образованием продукта конденсации. По такому пути протекает реакция двух молекул альдегида между собой (кротоновая конденсация).
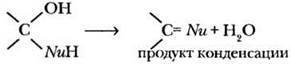
Кроме того, молекула воды может отщепляться и межмолекулярно, в этом случае возможно образование продукта поликонденсации. Такой путь реализуется, например, при реакции формальдегида с фенолом.
Характерной особенностью альдегидов, отличающей их от кетонов, является легкое окисление. На этом свойстве основаны качественные реакции на альдегидную группу.
Переходить к детализации химических свойств изучаемых классов соединений удобно, имея на плакате или слайде соответствующую схему. Пример такой схемы приведен на рисунке 26.
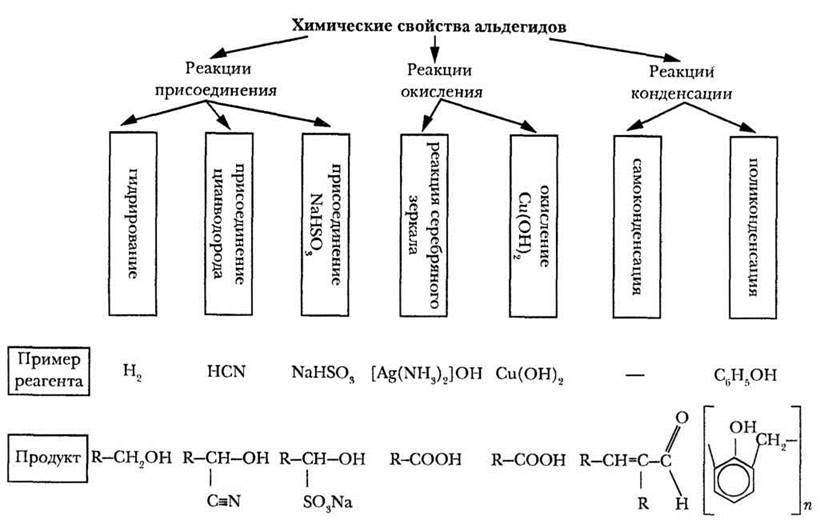
Рис. 26. Химические свойства альдегидов
II. Химические свойства альдегидов и кетонов
1. Реакции присоединения. Учитель связывает легкость протекания реакций присоединения с электронным строением карбонильной группы. Активность альдегидов и кетонов в реакциях присоединения полярных веществ определяется величиной частичного положительного заряда на атоме углерода карбонильной группы. Легкость протекания таких реакций увеличивается в ряду: кетоны < альдегиды < формальдегид. Как это объяснить? Это следствие положительного индуктивного эффекта алкильных заместителей при карбонильной группе, уменьшающих частичный положительный заряд на реакционном центре. Самым активным из карбонильных соединений является формальдегид, т. к. его молекула не содержит алкильных радикалов.
Гидрирование. Присоединение водорода по кратной связи С=О происходит при нагревании в присутствии катализаторов гидрирования (никель, платина, палладий):
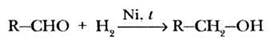
![]()
В результате образуются спирты соответствующего строения. Это реакция, обратная получению карбонильных соединений из спиртов. Внимательные учащиеся смогут ответить на вопрос: чем отличаются друг от друга спирты, полученные гидрированием альдегидов и кетонов? Из альдегидов можно получить только первичные спирты, гидрированием кетонов — только вторичные.
Присоединение циановодорода. Альдегиды и кетоны присоединяют по карбонильной группе полярную молекулу синильной кислоты (циановодород). Присоединение идет в соответствии с распределением электронной плотности в реагентах:
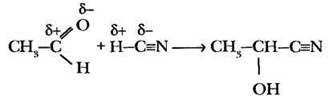
Образующийся продукт реакции относится к классу циангидринов (нитрил оксикислоты) и содержит на один атом углерода больше, чем исходный альдегид. Такая реакция применяется для наращивания углеродной цепи в органических молекулах.
Присоединение гидросульфита натрия. Альдегиды в отличие от кетонов способны присоединять молекулу гидросульфита натрия. Эта важная реакция позволяет не только обнаружить альдегиды, но и выделить их из смеси с другими веществами. Образующиеся сульфопроизводные выпадают в осадок и очень легко разлагаются кислотами с образованием исходного альдегида:
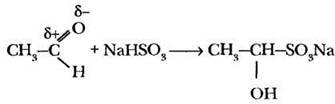
Присоединение реактивов Гриньяра. В профильном классе невозможно не упомянуть об одной из выдающихся страниц препаративной органической химии — использовании в синтезах магнийорганических соединений. Начало XX в. в органической химии ознаменовалось выдающимся событием. В 1900 г. французский химик Франсуа Огюст Виктор Гриньяр сообщил о получении органических веществ, в которых содержался связанный с углеродом атом металла — магния:
![]()
Поскольку на атоме углерода, связанном с металлом, сосредоточен частичный отрицательный заряд (почему?), реактивы Гриньяра сразу же после их открытия стали использоваться как уникальные нуклеофильные реагенты для синтеза углеводородов, спиртов, кетонов, альдегидов, карбоновых кислот и их производных. Работы Гриньяра положили начало универсальным методам магнийорганического синтеза, открыли новый этап в развитии препаративной органической химии. На примере взаимодействия реактивов Гриньяра с карбонильными соединениями (см. учебник) учитель объясняет, как можно «сконструировать» молекулы первичных, вторичных или третичных спиртов заданного строения.
2. Реакции окисления. Альдегиды в отличие от кетонов легко окисляются. Эти реакции используются как в целях органического синтеза, так и для качественного обнаружения альдегидов.
Наступило время демонстрационного эксперимента. Учитель уже объяснил, что в результате окисления альдегидов образуется новый класс веществ, называемый карбоновыми кислотами. В качестве окислителя можно использовать и кислород воздуха, и неорганические соли (перманганат калия), и даже такие специфические слабые окислители, как аммиачный раствор оксида серебра или гидроксид меди (И).
Для проведения реакции «серебряного зеркала» учителю потребуется чисто вымытая пробирка. В нее наливают 2-3 мл 1%-ного раствора нитрата серебра и небольшими порциями добавляют 10%-ный раствор аммиака до полного растворения образующегося вначале серого осадка оксида серебра. (При отсутствии в лаборатории нитрата серебра можно воспользоваться раствором измельченного аптечного ляписного карандаша в воде). К полученному раствору комплексного соединения приливают 1-2 мл раствора альдегида. Поскольку, как правило, формалина в школьной лаборатории нет, можно использовать 2%-ный раствор глюкозы (в порошке или ампулах продается в аптеке). Следующий этап — самый ответственный. Для получения ровного зеркального налета пробирку следует держать вертикально и вращать вокруг пламени горелки, нагревая не дно, а стенки. Избегать закипания жидкости! Если опыт получился, зеркальную пробирку можно сохранить для последующих демонстраций, высушив и залив ее парафином.
Для учащихся общеобразовательных классов окислитель в уравнении реакции можно изображать в виде оксида серебра Ag2О.
В профильном классе учитель знакомит ребят с «аммиачным раствором оксида серебра» более подробно. В 1881 г. немецкий химик Бернгард Толленс предложил использовать для обнаружения в растворе соединений с альдегидной группой комплексное соединение серебра. При добавлении к раствору нитрата серебра водного раствора аммиака происходит выпадение серо-черного осадка оксида, поскольку гидроксид серебра при обычных условиях не существует.
![]()
Оксид серебра растворяется в избытке аммиачнои воды, образуя комплексное соединение.
![]()
Полученный бесцветный раствор и получил название реактива Толленса.
Второй демонстрационный эксперимент проводится так. В пробирке получают осадок гидроксида меди (II), добавляя к раствору сульфата меди (П) немного гидроксида натрия. В ту же пробирку приливают 3-4 мл раствора альдегида (с глюкозой опыт также получается замечательно) и нагревают. Смесь приобретает сначала бурый оттенок, а затем отчетливо виден кирпично-красный мелкокристаллический осадок оксида меди (I).
Кетоны окисляются только в очень жестких условиях (нагревание с азотной или хромовой кислотами) с разрывом углерод-углеродных связей, ближайших к карбонильной группе.
3. Реакции конденсации. К сожалению, этому замечательному свойству альдегидов и кетонов в школьном курсе уделяется совсем немного внимания. Вероятно, потому, что органики сами до конца не разберутся, что же называть реакциями конденсации. Химическая энциклопедия трактует это понятие, как исторически сложившееся название широкой группы реакций самого различного характера. Поэтому в данном разделе мы приведем несколько наиболее значительных превращений, характерных для альдегидов и кетонов, и пусть простят нас корифеи органической химии, если не все приведенные процессы в полной мере можно отнести к реакциям конденсации.
Изучением свойств альдегидов занимался выдающийся русский химик и композитор, автор знаменитой «Богатырской симфонии» и всемирно известной оперы «Князь Игорь» Александр Порфирьевич Бородин. В 1872 г. он обнаружил, что при действии металлического натрия на альдегиды образуются не только продукты их диспропорционирования (спирт и карбоновая кислота), но также вещества с удвоенной по сравнению с альдегидом молекулярной массой. Детальное исследование необычного продукта привело ученого к выводу, что вещество содержит одновременно и альдегидную, и гидроксильную группы, то есть является альдегидоспиртом (альдолем). По химическому строению альдоль представлял собой продукт присоединения одной молекулы альдегида к другой:
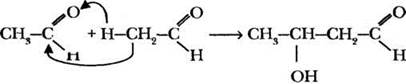
Открытая Бородиным реакция получила название альдольной конденсации. Она протекает в щелочной среде и широко используется в промышленности для получения синтетического каучука, смол, лаков и душистых веществ.
Оказалось, что альдоли очень легко дегидратируются с образованием непредельных альдегидов с сопряженными С=С и С=О связями. По тривиальному названию продукта, получаемого при этом из уксусного альдегида (кротоновый альдегид), конденсацию такого типа назвали кротоновой:
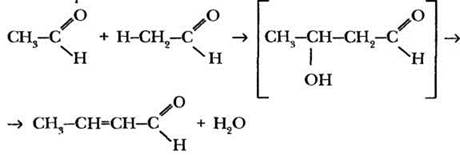
Наиболее практическими значимыми реакциями конденсации альдегидов являются реакции поликонденсации, в частности с фенолом. Если в качестве альдегида использован формальдегид, образуется полимерный продукт — фенолоформальдегидная смола. Этот материал уже знаком ребятам по теме фенолы.
4. Реакции замещения по α-углеродному атому. Учитель вновь увязывает данный вопрос со взаимным влиянием групп атомов в молекулах органических соединений. Оказывается, не только алкильные заместители оказывает влияние на свойства карбонильной группы, уменьшая положительный заряд на атоме углерода по сравнению с метаналем. Карбонильная группа активирует α-углеродный атом связанного с ним радикала. Например, реакции замещения с галогенами притекают даже в отсутствии катализатора или освещения.
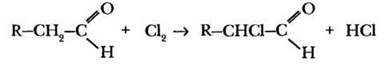
При избытке галогена замещению могут подвергаться все атомы водорода в a-положении к карбонильной группе. В 1831 г. Ю. Либих действием хлора на ацетальдегид впервые получил вещество, названное хлораль:
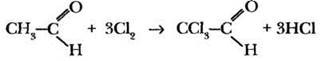
На основе хлораля получают некоторые средства борьбы с насекомыми (инсектициды), в том числе хлорофос, а также гербициды.
На том же свойстве основана качественная реакция на метилкетоны и ацетальдегид — йодоформная реакция или проба Люголя, с которой учащиеся познакомились на примере этилового спирта. Учитель может повторить ее, обнаружив ацетон в товарном растворителе. Преамбула эксперимента такова. Многие кетоны являются хорошими растворителями для лаков и красок. Например, ацетон входит в состав таких выпускаемых промышленностью смесей, как «Растворитель 645» и «Растворитель 646». Содержание пропанона-2 (ацетона) в них можно обнаружить с помощью йодоформной реакции. В пробирку, содержащую 2 мл воды, добавляют 8-10 капель растворителя. Полного растворения не наблюдается, поскольку в состав исследуемой жидкости входят нерастворимые в воде толуол и сложные эфиры. Затем в пробирку добавляют 1 мл 10%-ного раствора гидроксида натрия и 0,5-1 мл раствора реактива Люголя (его приготовление см. в теме «Спирты»). Если смесь окрашена, ее обесцвечивают добавлением раствора щелочи. Образуется желтый осадок (или помутнение) и ощущается резкий неприятный запах трийодметана (йодоформа).
![]()
Строго говоря, положительную реакцию может дать не только ацетон, но и этанол, содержащийся в этих растворителях, хотя об этом можно и умолчать. Если же учитель не хочет хитрить, опыт можно показать с чистым ацетоном.
Задание 1
1-й уровень
Запишите уравнения реакций, с помощью которых можно осуществить цепочку превращений. При необходимости укажите условия протекания реакций:
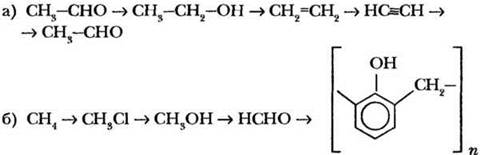
2-й уровень
В трех пробирках без этикеток находятся растворы уксусного альдегида, этиленгликоля и ацетона. Как при помощи растворов сульфата меди (II) и гидроксида натрия узнать, где какое вещество?
Задание 2
1-й уровень
Органическое вещество содержит 62,0% углерода, 27,6% кислорода и 10,4% водорода и легко восстанавливает аммиачный раствор оксида серебра. Определите структурную формулу вещества.
2-й уровень
Какой объем формалина с массовой долей НСНО 40% (ρ = 1,1 г/мл) можно получить при окислении 200 мл 60%-ного раствора метилового спирта (ρ = 0,8 г/мл)?
Задание 3
1-й уровень
При окислении 450 мл пропанола-2 (ρ = 0,80 г/мл) получили 300 г кетона. Найдите массовую долю выхода продукта реакции.
2-й уровень
При окислении 4,3 г альдегида аммиачным раствором оксида серебра выделилось 10,8 г металла. Напишите формулы всех возможных изомеров и назовите их по международной номенклатуре.