Настольная книга учителя химии 10 класс - поурочные разработки
ПОНЯТИЕ КАРБОНОВЫХ КИСЛОТ, ИХ КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА. СТРОЕНИЕ КАРБОКСИЛЬНОЙ ГРУППЫ И ФИЗИЧЕСКИЕ СВОЙСТВА ПРЕДЕЛЬНЫХ ОДНООСНОВНЫХ КИСЛОТ - КИСЛОРОДОСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
Цели урока. Дать понятие о карбоновых кислотах и их классификации в сравнении с минеральными кислотами. Рассмотреть основы международной и тривиальной номенклатуры и изомерию этого типа органических соединений. Разобрать строение карбоксильной группы и спрогнозировать химическое поведение карбоновых кислот.
Оборудование: образцы органических кислот: уксусная, щавелевая, лимонная, бензойная и др. Модели молекул Стюарта—Бриглеба.
I. Вступительное слово учителя
С древнейших времен люди знали, что при скисании вина образуется уксус, который использовали для придания пище кислого вкуса. Конечно, это была не единственная кислая приправа. С той же целью использовались, например, листья щавеля, стебли ревеня, сок лимона или ягоды кислицы. Разумеется, тогда никто и не думал о том, что кислый вкус во всех случаях обусловлен присутствием соединений одного класса органических веществ — карбоновых кислот. Тем не менее, относительно чистую уксусную кислоту научились получать еще в VIII в. Датой получения безводной уксусной кислоты можно считать 1789 г., когда русский химик Товий Егорович Ловиц нашел способ ее обезвоживания с помощью активированного угля. Такая кислота при охлаждении до температуры 16,5 °С кристаллизовалась в массу, очень напоминающую лед, отчего и получила название «ледяная».
Многие из вас не избежали искушения воткнуть в муравейник тонкий прутик, посмотреть на панику муравьев, а потом лизнуть «непрошеного гостя». Насекомые самоотверженно «прогоняли» его, выстреливая из специальных желез жидкость, содержащую кислоту.
Еще в XVI в. было обнаружено, что выделяющийся из муравейников «кислый пар» изменяет синий цвет растительных красителей на красный. Неудивительно, что Дж. Рей, впервые получив новую кислоту перегонкой... муравьев, назвал ее муравьиной.
Благодаря работам выдающегося шведского химика Карла Вильгельма Шееле к концу XVIII в. стало известно около десяти различных органических кислот. В 1769-1782 гг. он выделил и описал лимонную, молочную, бензойную, щавелевую и другие кислоты. Начало XIX в. ознаменовалось получением из природных источников большого числа органических кислот. Однако вплоть до 60-х гг. их химическое строение все еще оставалось невыясненным.
II. Понятие о карбоновых кислотах и их классификации
Что же объединяет такие разные по происхождению и нахождению в природе органические вещества? Учащиеся сами определяют, что все они содержат функциональную группу, называемую карбоксильной, и относятся к очень многочисленной группе органических веществ, называемых карбоновыми кислотами.
Учитель обобщает сказанное учащимися, дает определение карбоновых кислот и поясняет этимологию термина карбоксильная группа, как сочетание названий карбонильной и гидроксильной групп.
Классификацию карбоновых кислот удобно представить в виде схемы (рис. 28). Учитель поясняет, что такую классификацию проводят по двум главным признакам: типу углеводородного радикала и числу карбоксильных групп. Классификация по природе радикала типична для органических соединений. Она встречалась и для спиртов, и для альдегидов. Понятие «основность» — общее для органических и неорганических кислот. Учитель спрашивает, что понималось под основностью неорганических кислот? Число атомов водорода, способных замещаться или обмениваться на металл. То же самое справедливо и для кислот органических. Однако здесь легче считать карбоксильные группы, каждая из которых содержит один подвижный атом водорода.
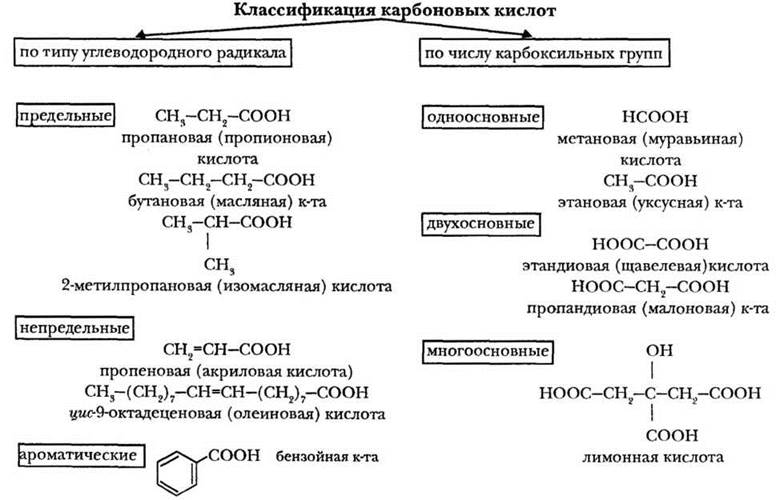
Рис. 28. Схема классификации карбоновых кислот
III. Номенклатура и изомерия карбоновых кислот
Схема классификации карбоновых кислот (см. рис. 28) удобна также для рассмотрения их номенклатуры и изомерии.
Наиболее важными для изучения в школьном курсе являются предельные одноосновные карбоновые кислоты, их гомологический ряд учитель и предлагает рассмотреть в первую очередь.
Родоначальником этого ряда кислот является кислота, в которой (подобно альдегидам) функциональная карбоксильная группа связана не с углеводородным радикалом, а с атомом водорода. Это метановая кислота НСООН. Учащиеся отыскивают формулу этой кислоты, а также следующих гомологов на схеме. Начиная с бугановой кислоты, в гомологическом ряду появляется возможность изомерии. Учитель спрашивает ребят, какой это тип изомерии? Учащиеся безошибочно называют её: изомерия углеродного скелета. Возможна для одноосновных карбоновых кислот изомерия положения функциональной группы? — спрашивает учитель далее. Очевидно, нет, поскольку карбоксильная группа может располагаться только на конце углеродной цепи.
При составлении международных названий кислот карбоксильный атом углерода всегда получает первый номер. Так логически параллельно с поиском гомологов учитель переходит к объяснению международной номенклатуры карбоновых кислот.
Для органических кислот более часто употребляются тривиальные названия. Поскольку многие из этих соединений известны очень давно, то эти термины указывают скорее на источник выделения, чем на химическую структуру кислот. Например, жжение при укусе муравья вызывается муравьиной кислотой, (от латинского formica — муравей); уксусная кислота впервые выделена из уксуса, образующегося при скисании вина; масляная кислота сообщает прогорклому маслу его типичный запах (латинское butyrum — масло — дало название масляной кислоте); капроновая кислота входит в состав козьего жира (от латинского caper — коза). Следует обратить внимание, что тривиальные названия альдегидов произошли именно от названий соответствующих им кислот.
Ребята с помощью учителя выводят общую формулу одноосновных кислот предельного ряда: СnН2nO2 или CnH2n+1, СООН, или RCOOH. В последней формуле придется предположить, что nможет быть равной нулю.
В качестве домашнего задания учитель просит учащихся изготовить карточку с формулами и названиями важнейших карбоновых кислот. Целесообразно дополнить таблицу 6 учебника колонкой с названиями остатков RCOO—. Это значительно облегчит составление названий солей, сложных эфиров, жиров.
Формулы и названия некоторых важнейших карбоновых кислот
|
Формула |
Тривиальное название |
Международное название |
Название радикала RCOO- |
|
НСООН |
муравьиная |
метановая |
формиат |
|
CH3COOH |
уксусная |
этановая |
ацетат |
|
СH3CH2COOH |
пропионовая |
пропановая |
пропионат |
|
CH3CH2CH2COOH |
масляная |
бутановая |
бутират |
|
СН3СН(СН3)СООН |
изомасляная |
2-метилпропановая |
изобутират |
|
СН3-(СН2)3-СООН |
валериановая |
пентановая |
валерат |
|
СН3-(СН2)4-СООН |
капроновая |
гексановая |
капрат |
|
СН3-(СН2)14-СООН |
пальмитиновая |
гексадекановая |
пальмитат |
|
СН3-(СН2)16-СООН |
стеариновая |
октадекановая |
стеарат |
|
CH2=CH-COOH |
акриловая |
пропеновая |
акрилат |
|
СН2=С(СН3)-СООН |
метакриловая |
2-метилпропеновая |
метакрилат |
|
С17Н33-СООН |
олеиновая |
цис-9-деценовая |
олеат |
|
C6H5-COOH |
бензойная |
бензойная |
бензоат |
|
HOOC-COOH |
щавелевая |
этандиовая |
оксалат |
|
HOOC-CH- COOH |
малоновая |
пропандиовая |
малонат |
|
НООС-(СН2)2-СООН |
янтарная |
бутандиовая |
сукцинат |
IV. Электронное и пространственное строение карбоксильной группы
Карбоксильная группа — еще один яркий пример взаимного влияния атомов в молекулах органических соединений. Учитель обращает внимание ребят на то, что они уже изучили свойства карбонильных и гидроксилсодержащих веществ. Могут ли обе эти группы находиться в одной молекуле? Конечно. И если они отделены друг от друга несколькими углеродными атомами, то вещество проявляет свойства как альдегидов (или кетонов), так и спиртов. Учитель имеет возможность повторить и закрепить пройденный материал. Он переходит к диалогу с классом.
Какова особенность электронного строения карбонильной группы и как это отражается на ее химических свойствах? Связь С=0 полярна, для нее характерны реакции нуклеофильного присоединения.
Какие свойства придает спиртам наличие гидроксила? За счет подвижности атома водорода спирты проявляют слабые кислотные свойства.
И вот две эти функциональные группы соединены между собой. Как распределена электронная плотность в получившемся фрагменте? Как это отражается на свойствах карбоновых кислот?
Учитель переходит к объяснению нового материала. Атом углерода карбоксильной группы находится в состоянии sp2-гибридизации. Он образует три σ-связи: две с атомами кислорода и третью с атомом водорода (в муравьиной кислоте) или углерода. За счет негибридизованной p-орбитали атома углерода и p-орбитали одного из атомов кислорода между ними образуется вторая связь, относящаяся к π-типу. Однако по сравнению с альдегидами и кетонами углеродный атом несет меньший положительный заряд. Это происходит благодаря положительному мезомерному эффекту атома кислорода гидроксильного фрагмента, имеющего неподеленную электронную пару на p-орбитали (рис. 29). Этот эффект «гасит» δ+ на атоме углерода. Таким образом, карбонильная группа карбоновых кислот уже не способна к реакциям присоединения и конденсации, характерным для альдегидов и кетонов. Вместе с тем, возрастает полярность связи О-Н гидроксильного фрагмента, ион водорода легче отщепляется, кислотные свойства карбоновых кислот значительно сильнее по сравнению со спиртами.
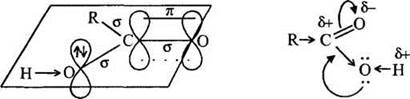
Рис. 29. Электронное строение карбоксильной группы
V. Физические свойства карбоновых кислот
Причина достаточно высоких температур кипения и плавления карбоновых кислот кроется в образовании ими прочных межмо- лекулярных водородных связей. Димерные молекулы, изображенные в учебнике, существуют не только в чистых жидкостях, растворах кислот, но даже в газовой фазе.
Учащимся знакомо такое физическое явление, как возгонка (сублимация). Учитель просит ребят дать определение этому понятию. Совместными усилиями получается приемлемая сентенция: переход вещества из твердого агрегатного состояния в газообразное, минуя жидкое, называется возгонкой. Для какого из изученных неорганических веществ это свойство особенно характерно? Кто-то из класса, вероятно, вспомнит кристаллический иод или «сухой лед» — твердый СО2. Среди органических веществ возгонка встречается более часто. Она применяется для очистки или выделения веществ из смесей. Продемонстрировать это явление учитель может с помощью красивого опыта.
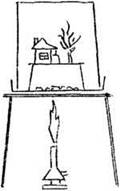
Рис. 30. Установка для демонстрации возгонки бензойной кислоты
На асбестовую сетку помещают чашку Петри или металлическую тарелку, в центр насыпают четверть чайной ложки бензойной кислоты. На чашку устанавливают небольшой каркас из проволоки, на котором укрепляют веточку в форме дерева (или побег комнатного растения), бумажный домик — то, что подскажет фантазия учителя. Всю эту конструкцию накрывают стеклянным стаканом объемом 1 л подходящего диаметра (рис. 30). Чашку Петри нагревают газовой горелкой. Температура возгонки бензойной кислоты — 100 °С, а плавления — 122 °С. Через некоторое время под стеклянным колпаком начинается настоящая метель! Искристый «снег» в виде инея оседает на фигурках, создавая неповторимый зимний пейзаж. Поскольку соблюсти температурный режим довольно трудно, кислота может расплавиться, но это не влияет на успех опыта. Осторожно! Разбирать установку только после полного охлаждения!
Задание 1
1-й уровень
Назовите по международной номенклатуре следующие карбоновые кислоты:
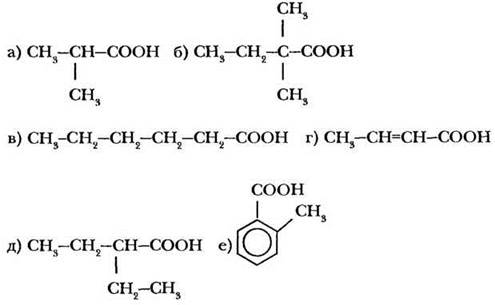
2-й уровень
Определите молекулярную формулу одноосновной карбоновой кислоты, содержащей 62,0% углерода и 27,6% кислорода. Составьте структурные формулы всех возможных изомеров и назовите их по международной номенклатуре.
Задание 2. Расположите в порядке усиления кислотных свойств перечисленные соединения.
1-й уровень
а) фенол; б) муравьиная кислота; в) хлороводородная кислота; г) пропанол-1; д) вода.
2-й уровень
а) этанол; б) n-крезол; в) бромоводородная кислота; г) вода; д) уксусная кислота; е) угольная кислота.
Задание 3
1-й уровень
В пищевой промышленности уксусная кислота используется в качестве консерванта и регулятора кислотности под кодом Е260. Напишите структурные формулы предыдущего и последующего гомологов этой кислоты, имеющих коды Е236 и E280 соответственно. Назовите оба вещества.
2-й уровень
Бутен-2-диовая кислота может существовать в виде двух геометрических изомеров. Транс-изомер имеет тривиальное название фумаровая кислота и используется в пищевой промышленности в качестве регулятора кислотности под кодом Е297. Цис-изомер называется малеиновая кислота, ее использование в качестве пищевой добавки запрещено. Напишите структурные формулы обеих кислот. Определите их принадлежность к гомологическим рядам в соответствии с принятой классификацией.