Настольная книга учителя химии 10 класс - поурочные разработки
ХИМИЧЕСКИЕ СВОЙСТВА И СПОСОБЫ ПОЛУЧЕНИЯ КАРБОНОВЫХ КИСЛОТ. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ, ИХ РОЛЬ В ПРИРОДЕ - КИСЛОРОДОСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
Цели урока. Рассмотреть общие свойства карбоновых кислот в сравнении со свойствами минеральных кислот. Дать понятие об особенных свойствах карбоновых кислот (реакции по радикалу и образование функциональных производных). Познакомить учащихся с наиболее характерными представителями карбоновых кислот и показать их значение в природе и жизни человека.
Оборудование: растворы НСООН, СН3СООН, НСl, CuSO4, NaOH, Na2CO3, NaCl; Zn, MgO, изоамиловый спирт, H2SO4 (конц.), лакмус или индикаторная бумага, раствор мыла. Демонстрационные образцы: аптечный пузырек муравьиного спирта, бутылочка пищевой уксусной кислоты или эссенции, долька лимона, яблоко, сухое белое вино, молочная сыворотка, стеариновая свеча.
I. Химические свойства карбоновых кислот
Проверку домашнего задания в профильном классе учитель может завершить рассмотрением электронного строения карбоксильной группы. Специфика гидроксила, входящего в карбоксильную группу, состоит в значительном усилении ее кислотных свойств по сравнению со спиртами. Кроме того, нельзя сбрасывать со счетов влияние углеводородного радикала на свойства карбоксильной группы, равно как и обратного воздействия. Характеризуя в целом химические свойства предельных одноосновных карбоновых кислот, учитель обращается к схеме, представленной на рисунке 31.
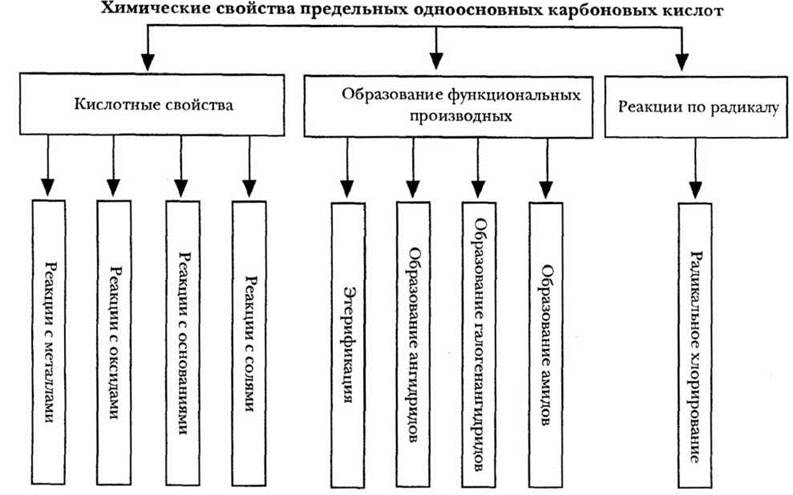
Рис. 31. Химические свойства карбоновых кислот
Кислотные свойства карбоксилсодержащих соединений аналогичны свойствам слабых неорганических кислот. Они взаимодействуют с активными металлами с выделением водорода, реагируют с основными оксидами, основаниями, солями кислот (по реакции ионного обмена). Кроме того, карбоновые кислоты обладают рядом специфических свойств. Прежде всего, это образование многочисленных производных и реакции по углеводородному радикалу.
1. Кислотные свойства. Кислотные свойства карбоновых кислот целесообразно рассматривать в сравнении с неорганическими, сопровождая объяснение демонстрационным экспериментом. У доски работают два ученика, один из которых пишет уравнения указанных учителем реакций для неорганической кислоты (например, хлороводородной), другой — для органической (лучше уксусной). Учитель во время написания уравнений демонстрирует эксперимент.
1) Электролитическая диссоциация. Как можно определить, что в растворе находится кислота? С помощью индикатора. Почему индикаторы в кислых растворах изменяют свой цвет? Это обусловлено присутствием катионов водорода Н+. Соляная кислота является сильным электролитом, полностью диссоциирует на ионы. (Первый ученик пишет на доске уравнение диссоциации хлороводородной кислоты). Кислотные свойства карбоновых кислот существенно слабее, они являются слабыми электролитами, равновесие диссоциации смещено влево. Тем не менее, они имеют кислый вкус и изменяют окраску индикаторов. Учитель демонстрирует это с использованием как раствора уксусной кислоты, так и с помощью демонстрационных образцов: дольки лимона (лимонная кислота), яблока (яблочная кислота), сухого вина (винная кислота), молочной сыворотки (молочная кислота). В водном растворе низшие кислоты диссоциируют с образованием катиона водорода и аниона кислотного остатка (запись на доске второго ученика):
![]()
2). Взаимодействие органических кислот с металлами учитель показывает на примере цинка. Реакция ускоряется при нагревании. Учащиеся пишут на доске соответствующие реакции с хлороводородной и уксусной кислотами. При написании формулы ацетата цинка могут возникнуть трудности. Учитель поясняет, что для солей органических кислот удобнее писать символ металла не до, а после кислотного остатка. Почему? В неорганических кислотах подвижный атом водорода изображается в формуле первым, а в органических — на последнем месте. Его и заменяют символом металла.
![]()
Следует обратить внимание ребят на заряды кислотного остатка и катиона металла, а, следовательно, и на определение числа кислотных остатков в формуле, т. е. на выведение формул солей органических кислот.
3) Реакцию с основными оксидами лучше демонстрировать с использованием оксида кальция или магния. Они легко растворяются в уксусной кислоте. На доске пишутся еще два уравнения реакции.
4) Для большей наглядности взаимодействие кислот с основаниями можно продемонстрировать на свежеосажденном гидроксиде меди (II). Голубой осадок растворяется, образуется такого же цвета раствор. Учащийся без труда записывает соответствующее уравнение реакции и дает название соли.
5) Карбоновые кислоты могут взаимодействовать с солями более слабых кислот по реакции ионного обмена. Это могут быть, к примеру, соли угольной кислоты. Во время демонстрации эксперимента учащиеся у доски записывают уравнения соответствующих реакций с хлороводородной и уксусной кислотами.
В классах с углубленным изучением химии учитель обязательно рассматривает влияние углеводородного радикала на силу карбоновой кислоты. Она определяется величиной частичного положительного заряда на атоме углерода карбоксильной группы. Чем больше этот заряд, тем в большей степени диссоциирует кислота, тем она сильнее. На величину δ+ атома углерода влияет заместитель, связанный с карбоксильной группой. В гомологическом ряду карбоновых кислот их сила падает с увеличением углеводородного радикала, то есть наиболее сильной является муравьиная кислота:
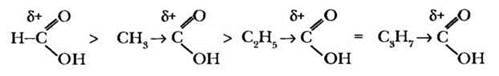
Если в непосредственной близости от карбоксильной группы углеводородный радикал содержит электроноакцепторные заместители, это увеличивает силу кислоты:
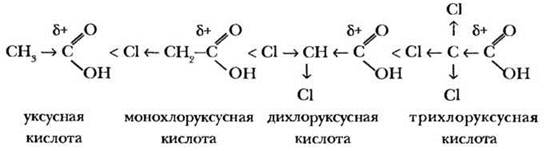
2. Реакция этерификации. Это свойство уже известно учащимся по теме «Спирты». В общеобразовательном классе учитель просит кого-либо из учащихся написать у доски реакцию уксусной кислоты с этиловым или метиловым спиртом, для профильного класса задание усложняется. В качестве спирта предлагается взять 3-метилбутанол-1 (изоамиловый спирт). Если спирт написан «гидроксильной группой вправо», учитель обращает внимание на правильность изображения остатка спирта в молекуле сложного эфира:
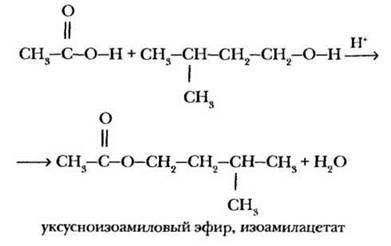
Реакцию этерификации проводят в присутствии концентрированной серной кислоты. Она выполняет роль катализатора и водоотнимающего средства.
Поскольку реакция этерификации обратима, в профильном классе учитель повторяет и закрепляет материал по смещению химического равновесия. Какие факторы оказывают влияние на положение равновесия в обратимой реакции?
1. Давление. Поскольку рассматриваемая реакция протекает в жидкой фазе, давление не оказывает влияния на положение равновесия.
2. Температура. Взаимодействие карбоновой кислоты со спиртом сопровождается поглощением тепла, однако тепловой эффект очень незначителен. Для ускорения установления равновесия реакцию проводят при повышенной температуре.
3. Концентрация участников реакции. Для смещения равновесия вправо образующаяся вода связывается концентрированной серной кислотой, а сложный эфир удаляется из сферы реакции.
Углубленное изучение предмета подразумевает знание механизмов важнейших химических реакций. Учащиеся отвечают, что этерификация относится к реакциям нуклеофильного замещения, субстратом является кислота, нуклеофильным реагентом — молекула спирта. Атака атома кислорода спирта по карбоксильному атому углерода кислоты приводит к тому, что при образовании сложного эфира гидроксильная группа отщепляется от кислоты, а атом водорода — от молекулы спирта.
При наличии в лаборатории изоамилового спирта в качестве демонстрационного эксперимента учитель показывает синтез изоамилацетата. В пробирку помещают по 1 мл уксусной кислоты, изоамилового спирта и концентрированной серной кислоты и осторожно нагревают при слабом кипении (под тягой!) в течение минуты. Образующуюся смесь выливают в стакан с насыщенным раствором хлорида натрия. На поверхности жидкости можно видеть маслянистые капли сложного эфира, обладающего характерным грушевым запахом (грушевая эссенция).
3. Реакции по углеводородному радикалу. Важнейшей реакцией предельных карбоновых кислот по углеводородному радикалу, связанному с карбоксильной группой, является галогенирование. На примере данной реакции учитель закрепляет понятие о взаимном влиянии атомов в молекулах органических соединений. Если природа радикала сказывается на кислотных свойствах карбоксильной группы, то обратное влияние последней на радикал сводится к активированию ближайшего к карбоксилу атома углерода в реакции с хлором или бромом. Взаимодействие протекает в присутствии красного фосфора в качестве катализатора.
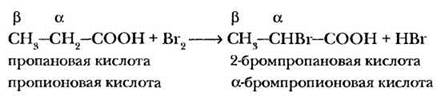
На примере бромирования пропионовой кислоты учитель знакомит ребят с заместительной номенклатурой, широко применяемой для названия производных карбонильных соединений и карбоновых кислот. Это подготовит учащихся к усвоению классификации аминокислот. Атомы углерода основной цепи обозначаются буквами латинского алфавита (α, β, γ, δ и т. д.), начиная от соседнего с карбонильной группы. В названии соединения перед тривиальным названием соответствующей кислоты указывается заместитель и его положение в углеродной цепи.
Если количество галогена в реакционной массе достаточное, происходит последовательное замещение на галоген всех водородных атомов в a-положении кислоты.
![]()
4. Образование функциональных производных. Функциональными производными карбоновых кислот называются соединения, в которых гидроксильная группа замещена на какую-либо иную группу или атом:
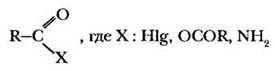
Общим свойством всех функциональных производных карбоновых кислот является то, что при гидролизе они вновь превращаются в исходную кислот)'. Сложные эфиры также относятся к функциональным производным кислот, однако реакция этерификации настолько важна, что рассматривалась отдельно. Радикал R—СО— называется ацильной группой или ацилом. В частности, остаток уксусной кислоты СН3СО— носит название ацетил.
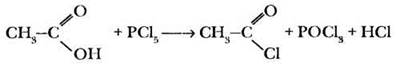
1) Образование галогенангидридов (X = Hlg — галоген). При действии на карбоновые кислоты хлорида или бромида фосфора (V) или фосфора (III) гидроксильная группа замещается на галоген:
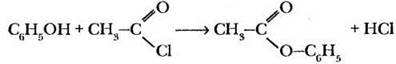
Галогенангидриды карбоновых кислот гораздо более активны, чем сами кислоты в реакциях нуклеофильного замещения, поскольку атом углерода функциональной группы несет больший положительный заряд. Например, получить сложный эфир фенола действием на него уксусной кислоты не удается, а при реакции с ацетилхлоридом легко образуется уксусно-фениловый эфир (фенилацетат):
Благодаря тому, что с помощью галогенангидридов в различные молекулы вводят ацильный фрагмент, их называют ацилирующими реагентами. Все галогенангидриды «боятся» присутствия влаги, поскольку очень легко гидролизуются с образованием соответствующих кислот:
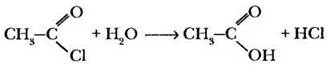
2) Образование ангидридов (X = О—СО—R). При действии на карбоновые кислоты водоотнимающих средств они претерпевают меж- молекулярную дегидратацию с образованием производных, называемых ангидридами.
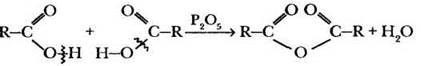
Упрощенно такую реакцию записывают в виде:
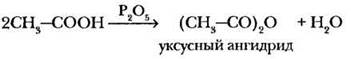
Ангидриды также являются сильными ацилирующими реагентами.
3) Образование амидов (X = NH2). При взаимодействии хлорангидридов кислот с аммиаком образуются производные кислот, называемые амидами:
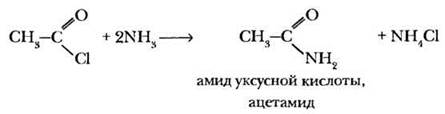
Амиды кислот можно получить при нагревании аммонийных солей карбоновых кислот:
![]()
4) Еще одним важным типом функциональных производных карбоновых кислот являются нитрилы. Это вещества, в которых карбоксильная группа «замаскирована» под нитрильный фрагмент —C≡N. Учитель спрашивает ребят, где в курсе органической химии встречались соединения, содержащие такую группу? Поскольку альдегиды и кетоны еще свежи в памяти, кто-то вспоминает присоединение синильной кислоты по карбонильной группе.
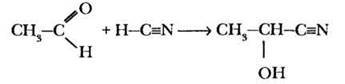
Второй возможный подход к получению нитрилов — взаимодействие галогеналканов с солями синильной кислоты:
![]()
Важно отметить, что обе эти реакции — способ увеличит! длину углеродной цепи на один атом.
При гидролизе в кислой среде нитрил сначала образует амид а затем карбоновую кислоту:
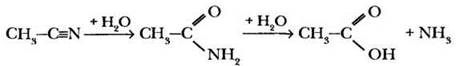
Материал, касающийся получения и свойств функциональных производных карбоновых кислот, достаточно объемен и сложен, мы приводим его только для классов с углубленным изучением химии. Требовать полного знания приведенных реакций, включать подобные задания в контрольные и проверочные работы вряд ли нужно его главная функция в данной теме — справочная.
II. Способы получения карбоновых кислот
В промышленности в большом количестве синтезируются алифатические монокарбоновые кислоты вплоть до С6 и кислоты с четным числом углеродных атомов до C18. Для синтеза карбоновых кислот молено использовать один из перечисленных ниже методов.
1. Реакции окисления
1) Окисление алканов. Ряд кислот в промышленности получают окислением предельных углеводородов. Практическое значение имеет каталитическое окисление метана до муравьиной кислоты. Другие алканы при окислении претерпевают разрыв углеводородной цепи примерно посередине. Так, при каталитическом окислении бутана получают уксусную кислоту:
![]()
Данный метод синтеза уксусной кислоты разработал профессор Московского университета Николай Маркович Эмануэль.
Практическое значение имеет окисление твердых алканов (парафинов). При этом углеводороды с длинной цепью (>С25) под действием кислорода воздуха в жидкой фазе в присутствии солей тяжелых металлов превращаются в смесь карбоновых кислот с длиной цепи С12—C18, которая используется для получения мыла и других поверхностно-активных соединений:
![]()
2) Окисление алкенов. Алкены с неразветвленной углеродной цепочкой окисляются по месту двойной связи с образованием карбоновых кислот:
![]()
В качестве окислителя можно использовать кипящии раствор перманганата калия или кислород воздуха в присутствии катализатора и при нагревании.
3) Окисление первичных спиртов и альдегидов. Первичные спирты при окислении первоначально превращаются в альдегиды и далее в карбоновые кислоты:
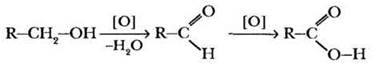
В качестве окислителей используются растворы перманганата или бихромата калия (КМnO4 или К2Сr2O7), раствор оксида хрома (VI) в серной кислоте.
2. Реакции гидролиза.
Карбоновые кислоты могут быть получены гидролизом их многочисленных производных. Однако практически используются лишь отдельные реакции, поскольку большинство производных сами получаются из кислот. Наибольшее значение имеет гидролиз нитрилов. Учитель напоминает, что такой прием позволяет увеличивать длину углеродной цепочки на один атом.
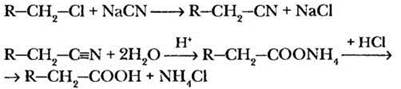
III. Важнейшие представители карбоновых кислот
1. Муравьиная кислота.
Пожалуй, каждый испытал на себе «кусачесть» злюки-крапивы. Жжение от ее прикосновения обусловлено помимо прочего действием муравьиной кислоты. В больших концентрациях муравьиная кислота ядовита, вызывает сильные химические ожоги. В промышленности ее получают взаимодействием гидроксида натрия с оксидом углерода (П) при повышенных температуре и давлении:
![]()
Муравьиная кислота обладает рядом специфических свойств. При взаимодействии с концентрированной серной кислотой (водоотнимающее средство) образуется оксид углерода (И). Это один из способов получения угарного газа в лабораторных условиях.
![]()
Учитель ставит перед ребятами проблемную ситуацию и при наличии в лаборатории муравьиной кислоты (или аптечного муравьиного спирта) иллюстрирует ее демонстрационным экспериментом. Оказывается, раствор муравьиной кислоты дает реакцию «серебряного зеркала». Почему? Внимательное рассмотрение структурной формулы этого вещества приведет ребят к выводу, что в этой кислоте имеется альдегидная группа, поэтому она обладает также свойствами альдегидов. Что же образует муравьиная кислота при окислении? Если под действием реактива Толленса альдегидная группа окисляется до карбоксильной, должно получиться вещество следующего строения:
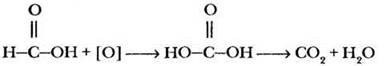
А это ничто иное, как угольная кислота, которая сразу же разлагается на углекислый газ и воду. В упрощенном варианте суммарное уравнение выглядит так:
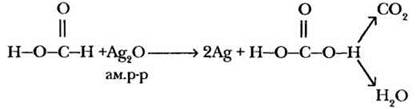
Благодаря этому свойству муравьиная кислота применяется в промышленности в качестве сильного восстановителя. Она также обладает бактерицидным действием и используется в медицине (1,25% раствор в спирте называют муравьиный спирт), для консервирования фруктовых соков, для дезинфекции пищевых емкостей. Формиат алюминия применяется в текстильной промышленности для пропитки тканей. Сложные эфиры муравьиной кислоты используют в качестве растворителей и душистых веществ.
2. Уксусная кислота.
Эта кислота известна с глубокой древности как продукт скисания вина на воздухе или под действием ферментов:
![]()
В настоящее время ее получают каталитическим окислением уксусного альдегида или бутана в присутствии марганецсодержащих катализаторов.
При комнатной температуре уксусная кислота — жидкость с резким запахом. Соли уксусной кислоты (ацетаты) хорошо растворимы в воде, за исключением ацетатов серебра и ртути (I). В отличие от муравьиной кислоты, уксусная устойчива к окислению.
Из всех карбоновых кислот уксусная имеет наибольшее применение в промышленности. Основная часть производимой кислоты используется для производства искусственных волокон и пластмасс на основе целлюлозы. Уксусная кислота применяется в производстве красителей (индиго), медикаментов (аспирин), ядохимикатов (2,4-Д), органического стекла. Сама кислота и ее эфиры являются хорошими растворителями. Раствор уксусной кислоты (3-8%-ный) используется в пищевой промышленности и в быту как вкусовое и консервирующее средство. В продажу поступает также 70%-ный раствор уксусной кислоты, а также 80%-ный, называемый уксусной эссенцией. Учитель обращает внимание на предостерегающие надписи, которыми снабжена этикетка бутылочки.
3. Высшие карбоновые кислоты.
Карбоновые кислоты с числом углеродных атомов больше 10, широко распространены в природе, обычно они имеют четное число атомов углерода и неразветвленную цепь. Высшие карбоновые кислоты встречаются в виде сложных эфиров с низшими спиртами — в эфирных маслах, в виде сложных эфиров с высшими спиртами — в воске, в виде эфиров с трехатомным спиртом глицерином — в жирах. К числу важнейших гомологов принадлежат пальмитиновая (гексадекановая) и стеариновая (октадекановая) кислоты, имеющие соответственно формулыC15H31COOH и C17H35COOH с неразветвленной углеродной цепью. Получают названные кислоты каталитическим окислением парафина или гидролизом жиров. Основное количество производимых высших кислот идет на изготовление мыла и других поверхностно-активных веществ, а также стеариновых свечей. Несмотря на нерастворимость этих кислот в воде, их кислотные свойства легко обнаружить в жидком состоянии. Если расплавленной стеариновой свечей капнуть на индикаторную бумагу, она покраснеет. Если позволит время, учитель демонстрирует получение стеариновой кислоты добавлением к раствору мыла соляной кислоты. Белые хлопья, собирающиеся на поверхности жидкости и есть смесь высших жирных кислот с преобладанием стеариновой.
4. Акриловая и метакриловая кислоты.
Простейшим представителем ряда непредельных карбоновых кислот является пропеновая (акриловая) кислота: СН2=СН—СООН. В промышленности акриловую кислоту получают каталитическим окислением пропена или гидролизом нитрила акриловой кислоты (акрилонитрил, НАК):
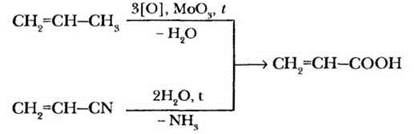
Гомологом акриловой кислоты является 2-метилпропеновая (меакриловая) кислота. Она содержится в виде сложных эфиров в ромашковом масле. В промышленности ее можно получить на основе ацетона циангидринным синтезом:
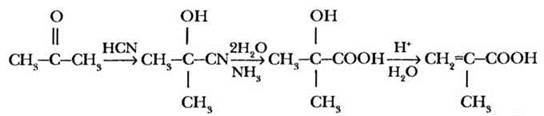
Непредельные кислоты сохраняют свойства алкенов: они обесцвечивают бромную воду и водный раствор перманганата калия, способны к реакциям присоединения. Важнейшее свойство непредельных кислот, их эфиров и нитрилов — способность к полимеризации. На этой реакции основано получение важных полимеров полиметилакрилата (художественная пластмасса), полиметилметакрилата (оргстекло, плексиглас), полиакрилонитрила (синтетическое волокно нитрон, ПАН):
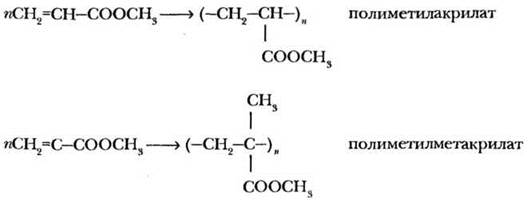
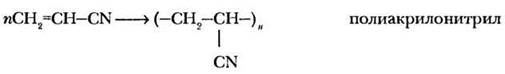
5. Высшие непредельные кислоты.
Высшие непредельные кислоты, содержащие одну, две или три двойных связи, широко распространены в природе и входят в состав растительных масел. Важнейшими представителями этих кислот являются олеиновая, линолевая и линоленовая кислоты:
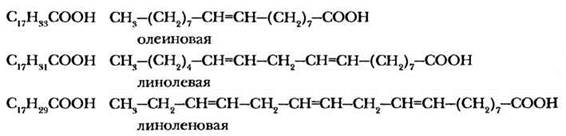
Все приведенные непредельные кислоты имеют цис-расположение заместителей при двойных связях. Указанные соединения также сочетают в себе свойства карбоновых кислот и алкенов: образуют производные по карбонильной группе и способны к реакциям присоединения.
Необходимые для жизнедеятельности человека линолевая и линоленовая кислоты не могут синтезироваться в организме и поступают в него только с растительными маслами. Они способствуют снижению содержания в крови холестерина. Способность непредельных кислот окисляться используется при изготовлении олифы из льняного и конопляного масла, в состав которых входят олеиновая и линолевая кислоты в виде сложных эфиров.
6. Бензойная кислота.
Простейшим представителем ароматических карбоновых кислот является бензойная кислота C6Н5—COOН. Она входит в состав различных природных смол, содержится в плодах и ягодах. В промышленности бензойную кислоту получают каталитическим окислением толуола воздухом при повышенных температуре и давлении в присутствии солей кобальта:
![]()
Отличительной особенностью ароматических кислот является их склонность к декарбоксилированию (разложению с выделением оксида углерода (IV)):
![]()
Ароматические кислоты сильнее алифатических, что объясняется акцепторными свойствами фенильного радикала. Соли бензойной кислоты называются бензоаты. Бензойную кислоту применяют в органическом синтезе для получения лекарственных препаратов, душистых веществ, красителей, а также в пищевой промышленности в качестве консерванта.
7. Щавелевая кислота.
Щавелевая кислота НООС—СООН является простейшим представителем двухосновных карбоновых кислот. Она и ее соли (оксалаты) содержится в листьях растений: щавеля, ревеня, кислицы. При нарушении обмена веществ в организме человека образуются камни почек, представляющие собой нерастворимый в воде оксалат кальция.
Щавелевая кислота кристаллизуется с двумя молекулами воды. Упрощенно формулу кристаллогидрата записывают Н2С2О4 · 2Н2О. Взаимное влияние двух карбоксильных групп выражается в усилении кислотных свойств дикарбоновых кислот по сравнению с монокарбоновыми. Щавелевая кислота растворима в воде и проявляет восстановительные свойства. Раствором перманганата калия в кислой среде она окисляется до углекислого газа:
![]()
При нагревании с концентрированной серной кислотой щавелевая кислота разлагается на оксиды углерода (II) и (IV) и воду:
![]()
Щавелевая кислота применяется в текстильной, кожевенной и пищевой промышленности.
Задание 1
1 уровень
Расположите в ряд по усилению кислотных свойств перечисленные кислоты и их производные: а) уксусная; б) пропионовая; в) хлоруксусная; г) стеариновая.
2 уровень
Какая из кислот будет реагировать с металлическим магнием с максимальной скоростью, а какая — с минимальной: а) пропановая; б) 2-хлорпропановая; в) 3-хлорпропановая? Напишите уравнения соответствующих реакций.
Задание 2
1 уровень
В качестве консерванта при производстве газированных напитков используется бензоат натрия (Е211). Напишите уравнения реакций синтеза этого вещества из бензола в соответствии со следующей схемой:
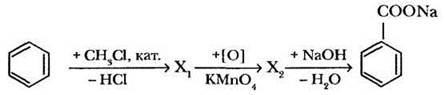
2 уровень
В сельском хозяйстве в качестве гербицида широко используется 2,4-дихлорфеноксиуксусная кислота, имеющая торговое название 2,4-Д. Приведите уравнения реакций синтеза этого гербицида из уксусной кислоты и фенола в соответствии со следующей схемой:
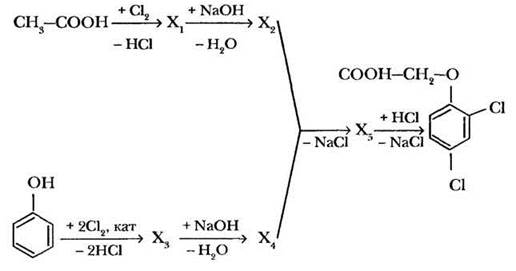
Задание 3
1 уровень
Достаточно ли 100 мл 97%-ного раствора уксусной кислоты (ρ = 1,04 г/мл) для растворения 100 г карбоната кальция? Какая масса соли при этом получится?
2 уровень
Некоторый спирт подвергли окислению, при этом образовалась одноосновная карбоновая кислота. При сжигании 13,2 г этой кислоты получили углекислый газ, для полной нейтрализации которого потребовалось 192 мл раствора гидроксида калия с массовой долей 28% (ρ = 1,25 г/мл). Установить формулу исходного спирта.