Настольная книга учителя химии 10 класс - поурочные разработки
ВАЛЕНТНЫЕ СОСТОЯНИЯ АТОМА УГЛЕРОДА - ВВЕДЕНИЕ
Цели урока. Дать понятие о гибридизации как о процессе выравнивания атомных орбиталий по форме и энергии. Рассмотреть три валентных состояния атома углерода, как следствие sp3-,sp2- и sp-гибридизации.
Оборудование: воздушные шары продолговатой формы (4 штуки), спички.
I. Понятие гибридизации. Первое валентное состояние атома углерода
При проверке домашнего задания учитель акцентирует внимание на строении внешнего электронного уровня атома углерода: какие орбитали и сколько их составляют этот уровень, распределение электронов по орбиталям в основном и возбужденном состояниях, форма s- и p-электронных облаков, взаимное расположение осей p-орбиталей. Учитель отмечает, что для атома углерода в органических веществах наиболее характерна валентность, равная четырем. Для этого при образовании химических связей атом должен перейти в возбужденное состояние, при котором один из 2s-электронов перемещается на 2/р-орбиталь. В качестве примера рассматривается молекула метана. Учащиеся, как правило, легко отвечают на поставленные вопросы:
1. Сколько химических связей в молекуле метана?
2. Каков тип связи С—Н?
3. К какому типу относятся эти связи (к σ- или π-типу)?
4. За счет перекрывания орбиталей какого типа происходит образование связей углерод—водород?
Ответ ребят на последний вопрос логичен: три связи образованы за счет перекрывания р-орбиталей углерода и 5-орбитали атомов водорода, четвертая связь — результат перекрывания двух s-орбиталей. Учитель создает проблемную ситуацию. Очевидно, что в таком случае одна из связей С—Н будет отличаться от трех остальных: по энергии, длине, направленности. Однако с помощью современных методов исследования доказано, что все связи в метане абсолютно равноценны! Почему? Для объяснения этого факта выдвинута гипотеза, называемая теорией гибридизации.
Исходя из того, что все связи в метане равноценны, остается предположить, что образованы они одинаковыми орбиталями атома углерода. Но ведь s- и р-облака существенно отличаются друг от друга! Значит, в соединениях у углерода уже нет орбиталей такой формы, они усредняются по форме и энергии. Такое явление и принято называть гибридизацией.
Учитель должен подчеркнуть два момента:
1) при гибридизации число орбиталей не изменяется, т. е. из одной s- и трех p-орбиталей образуется четыре новых;
2) на каждой из орбиталей новой формы остается по одному неспаренному электрону, за счет которых и образуются четыре связи С-Н.
Кстати, о форме гибридных орбиталей. Она напоминает гантель, но с разновеликими сферами. Точка между сферами с нулевой электронной плотностью совпадает с центром ядра атома углерода.
Следующий важный момент объяснения — пространственное расположение осей гибридных орбиталей. К нему можно подойти с помощью следующего задания. Учитель просит ребят расположить две спички так, чтобы их «хвостики» соприкоснулись, а головки были на максимальном удалении друг от друга (максимально оттолкнулись). Сделать это легко — спички лежат на одной прямой. То же самое надо проделать с тремя спичками, получается фигурка, напоминающая товарный знак «мерседеса». Теперь четыре спички. Чаще всего ребята показывают крест. Тогда учитель демонстрирует четыре воздушных шарика, скрепленных за «хвостики». Находясь в свободном полете, они максимально отталкиваются друг от друга, макушки шаров направлены к вершинам тетраэдра. Ошибка ребят была в том, что они располагали спички на плоскости, а не в трехмерном пространстве. Поскольку на каждой из гибридных орбиталей находится отрицательно заряженный электрон, они стремятся расположиться в пространстве наиболее выгодным образом, т. е. на максимальном удалении. При этом угол между осями будет равен 109°28', а сами оси направлены к вершинам тетраэдра.
Осталось присвоить новым орбиталям символьное обозначение. Каждая из них называется sp3-орбиталь, а соответствующее валентное состояние углерода — sp3-гибридизацией. Расшифровать это обозначение учитель просит самих учащихся.
II. Второе валентное состояние атома углерода
Существуют органические вещества, в которых атом углерода связан не с четырьмя, а с тремя соседними атомами, оставаясь при этом четырехвалентным. Как такое может быть? Только в том случае, если с одним из соседей углерод связан двойной связью. Ребятам уже знакомы такие вещества, например, этилен. Валентное состояние атомов углерода в этилене уже другое. Учитель объясняет, что здесь гибридизации подвергаются не четыре, а только три орбитали атома углерода: s- и две p-орбитали. Отсюда и тип взаимодействия орбиталей называют sp2-гибридизацией. Четвертое гантелеобразное р-облако остается негибридизованным.
Сняв один из шаров с «sp3-вязанки», учитель показывает, что оси трех гибридных sp2-орбиталей располагаются в одной плоскости под углом 120°. Связывая материал с темой предыдущего урока, учитель объясняет механизм образования σ- и π-связей в этилене, обращает внимание на различия в природе связей между атомами углерода (боковое перекрывание, прочность, доступность для реагентов), проводит сравнение с одинарной С—С связью в этане (длина, энергия, полярность).
III. Третье валентное состояние атома углерода
Следуя логике изложения, учитель просит ребят назвать органическое вещество, в котором атом углерода связан только с двумя соседними атомами. Из знакомых учащимся веществ это ацетилен. В этом соединении атомы углерода пребывают в третьем валентном состоянии — состоянии sp-гибридизации. Дальнейшие рассуждения полезно проводить с помощью ребят. Совместно необходимо дать ответы на следующие вопросы.
1. Сколько орбиталей подвержены гибридизации в третьем валентном состоянии?
2. Как расположены в пространстве оси sp-гибридных орбиталей, исходя из принципа их взаимного отталкивания?
3. Сколько и каких орбиталей осталось негибридизованными?
4. Как расположены в пространстве оси двух негибридизованных p-орбиталей по отношению друг к другу и осям sр-орбиталей?
Теперь из двух атомов углерода в состоянии «sp-гибридизации необходимо сконструировать молекулу ацетилена. Каждый углеродный атом образует две с-связи (с соседними атомами углерода и водорода) и две π-связи (друг с другом). Длина тройной связи еще короче межъядерного расстояния в этилене, энергия связи С≡С также возрастает, однако π-связь и в этом случае остается более доступной для атаки реагентов и менее прочной по сравнению с σ-связью.
Поскольку понятие гибридизации будет в дальнейшем закреплено при изучении соответствующих классов углеводородов, вдаваться в тонкости электронного и пространственного строения гомологов этана, этена и этина нецелесообразно. На уроке и после проверки домашнего задания учащиеся должны четко усвоить основные моменты теории гибридизации.
1. Как такового процесса гибридизации (в динамике) реально не существует, эта теория призвана описывать валентные состояния атома углерода в существующих молекулах (в статике).
2. Определить тип гибридизации атома углерода в любой молекуле очень легко по числу атомов-соседей. Если углерод связан с четырьмя другими атомами, он находится в состоянии sp3-гибридизации (сумма надстрочных индексов 1 + 3 = 4), с тремя атомами — в sp2-гибридизации (1 + 2 = 3), с двумя — sp-гибридизация (1 + 1 = 2).
3. Оси sp3-гибридных орбиталей расположены в пространстве под углом 109°28' и направлены по вершинам тетраэдра, оси sp2-гибридных орбиталей лежат в одной плоскости под углом 120°, оси sр-орбиталей совпадают — угол 180°.
Закрепить полученные знания можно, используя задания следующих типов.
Задание 1. Определите тип гибридизации каждого атома углерода в молекулах веществ, структурные формулы которых записаны.
1-й уровень
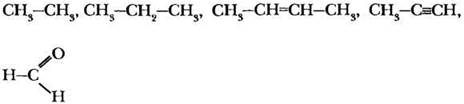
2-й уровень
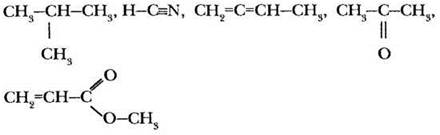
Задание 2. За счет перекрывания орбиталей какого типа образованы все ковалентные связи в молекулах следующих веществ.
1-й уровень
![]()
2-й уровень
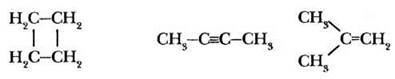
Задание 3. Какой тип гибридизации не существует и почему: sp-, sp2-, sp3-, sp4?