Настольная книга учителя химии 10 класс - поурочные разработки
ХИМИЧЕСКИЕ СВОЙСТВА И ПРИМЕНЕНИЕ АМИНОВ - АЗОТСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
Цели урока. Конкретизировать сделанный на предыдущем уроке прогноз о том, что амины — это органические основания, рассмотреть химические свойства их. Дать понятие об амидах и на их основе — о синтетических полиамидных материалах. Показать основные области применения аминов.
Оборудование: анилин и насыщенный раствор анилина, метиламина гидрохлорид, гидроксид натрия, хлороводородная кислота, бромная вода. Демонстрационные образцы: кусочек найлоновой ткани.
I. Химические свойства аминов
Объяснение нового материала учитель начинает с констатации того факта, что свойства алифатических аминов представлены прежде всего реакциями по атому азота. Для аминов ароматического ряда большое значение имеют также химические реакции по бензольному кольцу.
1. Основные свойства аминов. Поскольку амины проявляют основные свойства благодаря наличию неподеленной электронной пары у атома азота, учитель просит ребят вспомнить электронное строение аминогруппы. Необходимо провести аналогию с аммиаком как с точки зрения строения молекулы, так и способности присоединять протон, растворимости в воде, основных свойств водных растворов. При растворении в воде амины, подобно аммиаку, частично с ней взаимодействуют с образованием оснований — гидроксидов:
Будучи слабыми основаниями, гидроксиды аминов частично диссоциируют, их водные растворы имеют слабо щелочную реакцию и изменяют окраску индикаторов:
![]()
Как и аммиак, амины образуют соли с органическими и неорганическими кислотами.
![]()
Соли аминов представляют собой твердые вещества, имеющие ионный тип связи, хорошо растворимы в воде, в водных растворах полностью диссоциируют:
![]()
Сравнение основности различных аминов — важный вопрос, на который учащиеся должны уметь отвечать на основании анализа строения их молекул.
Основность аминов определяется главным образом числом и природой заместителей при атоме азота. Поскольку алкильные радикалы обладают положительным индуктивным эффектом, они увеличивают электронную плотность на азоте, основность амина возрастает. Метиламин — более сильное основание, чем аммиак, а диметиламин основнее метиламина. В анилине неподеленная электронная пара азота вовлечена в ароматическое сопряжение бензольного кольца (аналогичный эффект наблюдался в феноле), поэтому основность анилина значительно ниже, чем у аммиака:
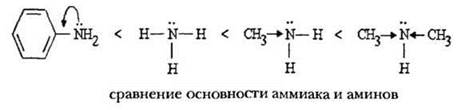
Про третичный амин — триметиламин — учитель может умолчать. Если же такой вопрос возникнет, то необходимо помнить: основность триметиламина чуть выше, чем у аммиака (и меньше, чем у метиламина) из-за пространственного экранирования пары электронов тремя метальными группами.
В щелочной среде соли аминов претерпевают реакцию ионного обмена, что позволяет получать амины из их солей:
![]()
2. Алкилирование. Взаимодействие аминов с галогеналканами позволяет получать вторичные и третичные амины из первичных. Выделяющийся галогеноводород связывают избытком амина или другими основаниями:
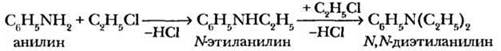
Третичные амины также реагируют с галогеналканами, при этом образуются так называемые четвертичные аммониевые соли:
![]()
3. Горение. Газообразные алифатические амины горят, прочие — окисляются кислородом при нагревании. Продукты горения — углекислый газ, азот и водяной пар:
![]()
Реакции электрофильного замещения ароматических аминов.
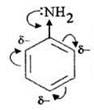
Говоря об основности аминов, учитель совместно с ребятами выяснил влияние бензольного кольца на аминогруппу. В свою очередь, атом азота в анилине и его гомологах существенно влияет на реакционную способность ароматического цикла. Увеличивая электронную плотность в кольце, аминогруппа облегчает протекание реакций электрофильного замещения, т. е. является активирующим заместителем. Кроме того, в цикле происходит перераспределение электронной плотности, в результате которого она возрастает в орто- и пара-положениях. Именно сюда и направляется атака электрофильного реагента. Например, анилин легко (при комнатной температуре, без катализатора) реагирует с бромной водой, в результате чего образуется белый осадок 2,4,6-триброманилина:
Свойства какого производного бензола напоминает анилин в этой реакции? Точно так же с бромной водой реагирует фенол. Гидроксильная группа и аминогруппа аналогичны по своему воздействию на ароматическое кольцо, это ориентанты первого рода.
5. Образование амидов. Первое представление об амидах у ребят должно было сложиться при изучении функциональных производных карбоновых кислот. Учитель подходил к формированию этого понятия «со стороны кислоты» (амид — это продукт замещения гидроксильной группы в карбоновой кислоте на аминогруппу). Теперь можно подвести учащихся к соединениям такого типа «со стороны аминов».
Учитель просит ребят написать уравнение только что изученной реакции алкилирования метиламина хлористым метилом:
![]()
Какие типы органических соединений, содержащих галогены, ребятам известны? Первыми в голову приходят хлоралкены, хлорарены, но это тоже галогенпроизводные углеводородов. А еще? С подсказкой учителя или без нее удается вспомнить галогенангидриды карбоновых кислот. Реагируют ли они с аминами? Оказывается, да, причем аналогично галогеналкаиам. Учитель просит кого-либо из учащихся написать уравнение этой реакции.
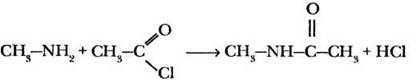
Что напоминает строение полученного продукта? Он очень похож на амид уксусной кислоты, только один из атомов водорода в аминогруппе замещен на метальный радикал. Но это тоже амид, и называется он метиламид уксусной кислоты. Введение в молекулу амина ацильного остатка (остатка карбоновой кислоты R—СО) называется реакцией ацилирования. Ребятам известен еще один ацилирующий реагент — ангидрид кислоты. Будет ли он реагировать с аминами? При взаимодействии аминов с ангидридами кислот также образуются амиды:

Можно ли получить амид непосредственно из карбоновой кислоты и амина? Это возможно только при повышенной температуре, поскольку без нагревания кислоты с аминами образуют соли. В качестве примера учитель может привести реакцию, данную в учебнике.
II. Синтетические полиамидные материалы
Логическим завершением темы станет формирование у учащихся понятия о полиамидах, как одном из основных типов синтетических волокон. Прежде чем обрисовать ребятам проблемную ситуацию, учитель делает небольшой исторический экскурс.
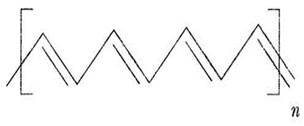
С 20-х гг. XX в. американская химическая компания «Дюпон» стала лидером в разработке и производстве полимеров. С 1928 г. это направление исследований возглавил 32-летний химик Уоллес Хьюм Карозерс. К тому времени уже многое было известно о химическом строении не только синтетических, но и природных полимерных веществ. Химики знали, что шерсть и шелк являются полиамидами и содержат в своем составе многократно повторяющийся фрагмент - СО—NH—. Для построения полиамидной цепи Карозерс решил использовать дифункциональные соединения: диамины и дикарбоновые кислоты. Учитель ставит перед учащимися вопрос: чем отличается взаимодействие таких веществ от реакции одноосновной карбоновой кислоты с амином? Наглядная схема поможет ответить на этот вопрос:
Каждая молекула образует не одну, а две амидные связи, в результате чего цепочка может удлиняться в обе стороны, образуется линейная полимерная молекула. Учитель задает вопрос: как называется процесс образования полимера, в результате которого выделяется побочное низкомолекулярное вещество? Это реакция поликонденсации. Образующийся продукт будет относиться к типу полиамидов. Из расплавленной массы полиамида можно вытягивать очень тонкие прочные нити. Это полиамидное синтетическое волокно. Оно идет на изготовление тканей, получивших общее название найлон.
Если в реакцию поликонденсации ввести 1,6-диаминогексан (гексаметилендиамин) и гександикарбоновую кислоту (адипиновая кислота), то полученный полимер будет иметь название найлон-6,6 (по числу атомов углерода в каждом мономере):
Как уже было сказано, гораздо быстрее реакция протекает не с карбоновой кислотой, а с хлорангидридами кислот. В промышленности реализуется и такая реакция:
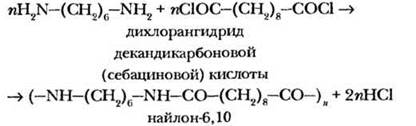
Карозерс впервые синтезировал найлон весной 1935 г. В 1938 г. в продаже появилось первое изделие из этого полимера — зубная щетка с синтетической щетинкой. Через год на прилавках магазинов покупатели увидели найлоновые чулки. Однако главным образом найлон шел на изготовление искусственного шелка для пошива одежды и парашютов.
К сожалению, Карозерс не стал свидетелем триумфа своего изобретения. Его неудовлетворенность жизнью и смерть любимой сестры довели его до самоубийства: 29 апреля 1937 г. он покончил собой, выпив коктейль из смеси лимонного сока и цианистого калия. Через семь месяцев у него родилась дочь Джейн...
Полиамиды — это не только синтетические волокна, но и важные конструкционные материалы. Из них можно изготавливать многие изделия (например, детали машин), заменяя в этом отношении металлы. Полиамиды химически инертны и очень прочны. Нить из найлона в десятки раз прочнее, чем полиэтиленовая. Это обусловлено наличием многочисленных межмолекулярных водородных связей между линейными молекулами полиамида.
Потребности и пристрастия человека очень изменчивы. Мода на синтетические ткани стала заметно ослабевать к семидесятым годам XX в. Причина состояла в том, что найлон гидрофобен, то есть не пропускает влагу и водяные пары. Для дождливой погоды или изготовления спецодежды это, конечно, большой плюс. Но человек в одежде из найлона потеет, носить ее недостаточно комфортно. Вкусы покупателя изменились, и спросом вновь стали пользоваться изделия из мягких натуральных тканей. Но техническая мысль ученых и инженеров не дремала. Химики научились не только уменьшать толщину нити, но и «распушать» пряжу. Это достигалось благодаря образованию на нити многочисленных завитков, петель, спиралей. Такая ткань была мягкой, как хлопок, из-за значительно меньшей плотности. Но главное — токая ткань стала «дышать»: она пропускала водяные пары от тела, но не пропускала снаружи капли воды! Новое волокно назвали тактелом. Таким образом, техническая мысль позволила удовлетворить потребности человека в комфорте, не синтезируя для этого новые полимеры.
Поистине химия — это наука чудес! Она способна создавать такие материалы, которые по своим свойствам значительно превосходят природные. В диалоге с учащимися учитель выясняет, что диамины и дикарбоновые кислоты бывают не только алифатическими, но и ароматическими. В качестве примера учитель приводит формулы 1,4-диаминобензола (n-фенилендиамин) и 1,4-бензолдикарбоновой (терефталевой) кислоты. Можно ли на их основе получить полиамид? Технически это оказалось не очень просто. Из-за отсутствия подходящего растворителя полимерные цепи никак не получались достаточно длинными. Решение проблемы стало довольно неожиданным: в качестве растворителя использовали концентрированную серную кислоту.
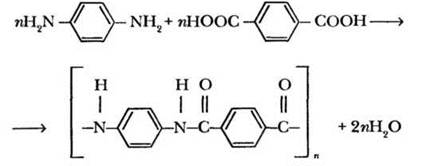
Полученный полимер назвали кевлар. Из него изготавливают поистине уникальное суперволокно! Этот материал очень огнестоек из-за малого содержания в нем водорода и достаточно гибок. Плотность кевлара в четыре раза меньше, чем у стали, но при этом он в пять раз прочнее! Из него изготавливают канаты, защитные костюмы пожарных и гонщиков формулы 1, детали крыльев самолетов, корды для автомобильных шин, пуленепробиваемые жилеты и куртки фехтовальщиков.
Приведенный материал должен убедить ребят, что благодаря достижениям современной химической науки появилась возможность создавать уникальные вещества и материалы, которых нет в природе. Такие привычные для нас вещи, как вычислительная техника или лекарства, полет в космос или ксерокопирование, трансгенные организмы или ядерная энергетика стали возможны благодаря тесной взаимосвязи химии с другими науками.
Задание 1. Расположите вещества в порядке усиления основных свойств.
1-й уровень
а) аммиак; б) этиламин; в) анилин
2-й уровень
а) отолуидин; б) анилин; в) n-нитроанилин; г) аммиак; д) гидроксид натрия; е) метиламин.
Задание 2. Запишите уравнения реакций, с помощью которых можно осуществить цепочку превращений.
1-й уровень
![]()
2-й уровень
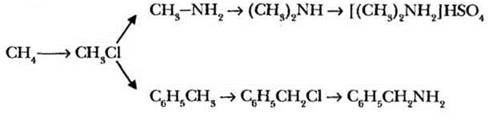
Задание 3
1-й уровень
Смешали 10 л газообразного метиламина и 10 г хлороводорода. Какой газ останется в избытке и каков его объем в тех же условиях?
2-й уровень
Смесь фенола и анилина полностью прореагировала с 40 г 5%-ного раствора гидроксида натрия. Такая же масса этой смеси может прореагировать с бромной водой, содержащей 72 г брома. Определите массы фенола и анилина в исходной смеси.