Настольная книга учителя химии 10 класс - поурочные разработки
АМИНОКИСЛОТЫ, ИХ СТРОЕНИЕ И СВОЙСТВА - АЗОТСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
Цели урока. Дать понятие об аминокислотах как органических амфотерных соединениях и рассмотреть их строение, классификацию, изомерию и номенклатуру. Предложить разобрать основные способы получения и применения аминокислот.
Оборудование: глицин, формалин, растворы нингидрнна, NaOH, фенолфталеина, универсальная индикаторная бумага. Демонстрационные образцы: капроновая ткань, аптечная упаковка глицина.
I. Первое знакомство с аминокислотами
Для учащихся это знакомство состоялось почти год назад — в конце 9-го класса. А для химиков? И учитель делает следующее сообщение с акцентом на межпредметные связи с биологией. Несколько раньше, в 1820 г., именно тем далеким летом французский химик Анри Браконно проводил свои опыты с веществами животного происхождения. В результате длительного нагревания кожи, хрящей и сухожилий с раствором серной кислоты он получил некоторое количество белых кристаллов сладкого вкуса. Какой тип реакций вероятнее всего протекал при этом? Очевидно, реакции гидролиза, катализируемые сильной кислотой. Ученый назвал новое вещество гликоколл. Учитель просит ребят вспомнить знакомые им однокоренные химические термины. Первым в памяти ребят возникает глицерин, через некоторое время — глюкоза, гликоген. Все эти слова происходят от греческого прилагательного glykys — сладкий. В настоящее время это название трансформировалось в глицин. Гликоколл долгое время считался «родственником» углеводов, пока в 1838 г. голландский химик Г. Мульдер не обнаружил в его составе азот. Спустя еще шесть лет Э. Хорсфорд установил формулу вещества — C2H6O2N.
II. Строение, классификация, номенклатура и изомерия аминокислот
Аминокислоты также, как углеводы, относятся к полифункциональным соединениям. Что это означает? В их молекулах содержится несколько функциональных групп. Сам термин «аминокислота» указывает на то, что в ее составе имеются аминогруппа и карбоксильная группа. Простейшей аминокислотой как раз и является глицин или аминоуксусная кислота:
![]()
Учитель просит дать международное название глицину: 2-аминоэтановая или просто аминоэтановая кислота.
Следующий гомолог этого ряда соединений методически очень важен. После того как ребята вспомнили, что такое гомологи, им предлагается написать формулу второго представителя ряда. Кто-то сразу приходит к выводу, что в данном случае возможно существование двух изомеров. Необходимо написать их формулы и дать названия:

Какой это тип изомерии? Это изомерия положения функциональной группы. По взаимному расположению карбоксильной и аминогрупп в углеродной цепи различают α-, β-, γ-аминокислоты и т. д. Учитель напоминает, что обозначение углеродных атомов буквами латинского алфавита начинается от ближайшего к карбоксильной группе атома (но не самого карбоксила!). Еще проще строятся международные названия аминокислот. Только в этом случае нумерация атомов углерода начинается с карбоксильной группы. Наиболее важными являются α-аминокислоты, поскольку именно они служат «кирпичиками» для построения важнейших молекул живой природы — белков. Все встречающиеся в природе а-аминокислоты имеют свои тривиальные названия. Приведенное выше вещество называется аланином.
Общую формулу α-аминокислот можно изобразить в удобном для дальнейшего использования виде:
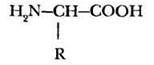
Учитель просит ребят внимательно посмотреть на эту формулу и определить, есть ли в молекуле асимметрический атом углерода. Для всех аминокислот, кроме глицина, асимметрическим центром является α-углеродный атом. Следовательно, могут существовать два оптических изомера. Их можно изобразить с помощью проекционных формул Фишера, знакомых по теме «Углеводы»:

Отнесение к D- или L-ряду проводят так же, как для глицеринового альдегида: для D-изомера аминогруппа изображается справа, для L-антипода — слева. В природе обнаружено около 150 различных аминокислот, но только немногим более 20 входят в состав белков. Удивительно, но все они являются оптическими изомерами и относятся к L-ряду. Примерно половина из их числа относится к незаменимым аминокислотам: они не могут синтезироваться в организме человека и поступают только с пищей. Учителю необходимо иметь в кабинете плакат с изображением формул и буквенных обозначений важнейших аминокислот наподобие того, который изображен ниже.
Структура и названия некоторых α-аминокислот
|
Формула |
Обозначение |
Название |
|
H2N-CH2-COOH |
Gly или Гли |
глицин |
|
CH3-CH(NH2)-COOH |
Ala или Ала |
аланин |
|
(CH3)2CH-CH(NH2)-COOH |
Val или Вал |
валин* |
|
(CH3)2CH-CH2-CH(NH2)-COOH |
Leu или Лей |
лейцин* |
|
C6H5-CH2-CH(NH2)-COOH |
Phe или Фен |
фенилаланин* |
|
HO-CH2-CH(NH2)-COOH |
Ser или Сер |
серии |
|
HS-СН2-CH(NH2)-COOH |
Cys или Цис |
цистеин* |
|
HOOC-CH2-CH(NH2)-COOH |
Asp или Асп |
аспарагиновая к-та |
|
H2N-CO-CH2-CH(NH2)-COOH |
Asn или Асн |
аспарагин |
|
HOOC-CH2-CH2-CH(NH2)-COOH |
Glu или Глу |
глутаминовая к-та |
|
H2N-CO-CH2-CH2-CH(NH2)-COOH |
Cin или Глн |
глутамин |
|
H2N-(CH2)4-CH(NH2)-COOH |
Lys или Лиз |
лизин* |
|
CH3-CH(OH)-CH(NH2)-COOH |
Thr или Тре |
треонин * |
* Звездочками обозначены названия незаменимых аминокислот
Группа R аминокислоты может быть как углеводородным радикалом, так и содержать атомы азота, кислорода, серы, различные циклы и функциональные группы.
III. Получение аминокислот
1. Исторически первым способом получения аминокислот был гидролиз белков. Кроме глицина А. Браконно удалось получить лейцин. Аспарагин и глутамин также были впервые выделены из природных объектов. Сложность состоит в том, что при гидролизе белков образуется смесь аминокислот, которую довольно трудно разделить на индивидуальные компоненты.
2. Удобным способом получения α-аминокислот является взаимодействие α-галогенпроизводных карбоновых кислот с аммиаком. Впервые таким способом английский химик-органик Уильям Перкин (старший) в 1858 г. получил глицин:
![]()
Учащиеся вспоминают, как синтезируют галогенпроизводные из карбоновых кислот.
3. В 1850 г. А. Штреккер предложил наиболее общий способ синтеза α-аминокислот из соответствующих альдегидов действием циановодорода, аммиака с последующим гидролизом нитрила до кислоты. Первой из синтезированных таким способом аминокислот стал аланин:
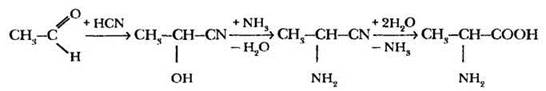
4. Самым перспективным в настоящее время является биотехнологический способ получения аминокислот. Особый штамм микроорганизмов, продуцирующих в больших количествах определенную аминокислоту, помещается в питательную среду и начинает свою работу. В результате получают не просто чистый продукт, а индивидуальный оптический изомер! Так, например, производят лизин и метиоин, используемые в качестве высокоэффективных кормовых добавок.
IV. Химические свойства аминокислот
1. Кислотно-основные свойства.
Особенность химического строения аминокислот состоит в том, что в одной молекуле этих веществ содержится как кислотная группа (—СООН), так и основная (—NH2). В водном растворе карбоксильная группа диссоциирует с отщеплением катиона водорода, который сразу же присоединяется по неподеленной электронной паре атома азота. Тем самым равновесие диссоциации еще более смещается вправо. Молекула аминокислоты превращается в особую частицу — биполярный ион или внутреннюю соль. Какова реакция среды в растворе такой аминокислоты? Среда будет нейтральная, что учитель и демонстрирует при помощи раствора глицина и индикаторной бумаги. Аминокислоты — амфотерные органические соединения. Они проявляют свойства как кислот, так и оснований. Существуют ли подобные вещества в неорганической химии? Амфотерными являются некоторые основания. Такие соединения способны реагировать как с кислотами, так и с основаниями, с образованием солей. Для удобства объяснения материала учитель рисует на доске схему, изображенную на рисунке 41.
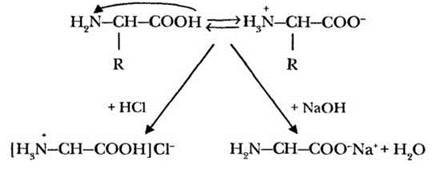
Рис. 41. Образование солей аминокислот
Благодаря амфотерным свойствам, растворы аминокислот способны связывать избыток катионов водорода или гидроксид-анионов, поддерживая постоянную кислотность среды, близкую к нейтральной. Такие растворы называются буферными. Упомянутое свойство аминокислот очень важно для поддержания постоянства pH биологических жидкостей.
Если в раствор аминокислоты погрузить два электрода и подключить постоянный ток, то в нейтральной среде биполярные молекулы не реагируют на наличие электрического поля. В кислой среде катион аминокислоты движется к отрицательному полюсу источника тока (катоду), а в щелочной аминокислота в виде аниона совершает направленное движение к аноду. Однако существуют аминокислоты, содержащие две карбоксильные группы и одну аминогруппу (например, аспарагиновая и глутаминовая кислоты) или наоборот (лизин). В водных растворах этих веществ среда будет соответственно кислой или щелочной.
Свободные аминокислоты содержатся в тканях растений и животных, в биологических жидкостях. На взаимодействии карбоксильной группы со щелочами основан метод определения их содержания. На факультативном занятии или лабораторной работе в профильном классе можно провести эксперимент, предложенный Т. В. Северюхиной и В. В. Сентемовым.
К 5 мл молока добавляют несколько капель фенолфталеина и добавляют 0,1 н раствор NaOH до появления розовой окраски. При этом нейтрализуются кислоты, не содержащие аминогруппы. К полученному раствору добавляют 2-3 мл формалина. Розовая окраска исчезает, а содержащиеся в растворе аминокислоты превращаются в имины, не имеющие амфотерного характера. Теперь их можно оттитровать щелочью, как обычные карбоновые кислоты.
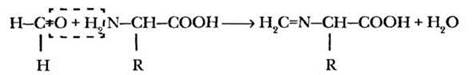
Полученный раствор титруют 0,1 н раствором NaOH до нового появления розовой окраски. Расчет концентрации свободных аминокислот ведут по формуле:
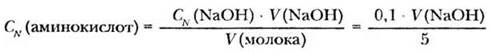
Опыт интересен еще и тем, что его можно использовать для исследования образца пищевого продукта в процессе хранения. С течением времени белки гидролизуются и содержание аминокислот возрастает.
2. Реакции этерификации.
Карбоксильная группа аминокислот сохраняет способность образовывать сложные эфиры. Реакция протекает в присутствии газообразного хлористого водорода в качестве катализатора:
![]()
3. Специфические свойства аминокислот.
1) Все α-аминокислоты образуют со специальным реагентом нингидрином сине-фиолетовое окрашивание, вызванное протеканием окислительно-восстановительного взаимодействия. Эта реакция является качественной на α-аминокислоты и используется для определения их количества в растворе. При наличии в лаборатории раствора нингидрина учитель может показать эффектный опыт. На листе белой бумаги делают надпись или рисунок водным раствором глицина и высушивают. Лист остается совершенно белым. При опрыскивании листа с помощью пульверизатора раствором нингидрина рисунок проявляется в виде ярких синих линий.
2) Аминокислоты, имеющие в своем составе бензольное кольцо, реагируют с концентрированной азотной кислотой, образуя нитропроизводные желтого цвета. Эта качественная реакция называется ксантопротеиновой.
4. Реакции конденсации.
Учитель еще раз повторяет важную мысль: аминокислоты сочетают свойства как аминов, так и карбоновых кислот. При изучении аминов рассматривалась реакция образования амидов карбоновых кислот. Действием каких реагентов можно превратить амины в амиды? Помимо ангидридов и галогенангидридов можно воспользоваться и самой карбоновой кислотой. И еще одно важное «воспоминание». Для получения полиамидного волокна Карозерс предложил использовать в качестве мономеров дикарбоновую кислоту и диамин. Как подобные реакции будут выглядеть для аминокислот, содержащих обе функциональные группы? Они также вступают в реакцию поликонденсации с образованием полиамидов. Например, при нагревании ε-аминокапроновой кислоты происходит отщепление воды за счет карбоксильной группы одной молекулы и аминогруппы другой:

Полученный полимер называется капроном и используется для получения искусственного волокна.
Природные α-аминокислоты также способны образовывать продукты конденсации — полипептиды и белки, о которых пойдет речь на следующем уроке.
V. Применение и биологическая функция аминокислот
Аминокислоты имеют исключительно важное значение для живых организмов не только как исходные вещества для построения полипептидов и белков, но и сами выполняют ответственные физиологические функции. Кроме того, аминокислоты и их производные используют многие отрасли промышленности: пищевая, медицинская, микробиологическая, химическая.
В 1806 г. французские химики-органики Луи Никола Воклен и Пьер Жан Робике исследовали состав сока некоторых растений. Из сока спаржи им удалось выделить белое кристаллическое вещество, названное ими аспарагином (от греческого названия спаржи — asparagus). Это была первая аминокислота, выделенная химиками из природных объектов (Браконно не выделил, а получил глицин гидролизом белка). В 1848 г. итальянец Рафаэль Пириа обнаружил, что гидролизом аспарагина можно получить аспарагиновую кислоту. В живых организмах аспарагиновая кислота, напротив, связывает токсичный аммиак, превращаясь в аспарагин:
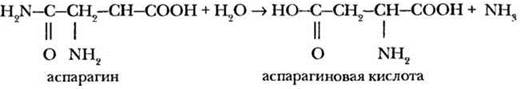
Из белка, содержащегося в зернах пшеницы, была выделена очень похожая по строению на аспарагиновую кислота, названная глутаминовой (по латыни gluten — клейковина). В значительных количествах она содержится в мозге, сердечной мышце и плазме крови. Она также способна взаимодействовать с аммиаком, превращаясь в амид — глутамин. Это ее свойство используется при лечении некоторых нервных заболеваний (шизофрении, эпилепсии).
Еще одно неожиданное свойство аминокислот. Предприимчивые японцы давно заметили, что добавление в пищу приправы из сушеных водорослей усиливает ее вкус и аромат. Химики уверены, что в основе любых явлений и проявлении жизни лежат химические вещества и реакции. В 1909 г. японский ученый К. Икеда выяснил, что причина такого действия приправы кроется в содержании глутаминовой кислоты и ее солей. Икеда запатентовал свое открытие, и теперь во всем мире в качестве пищевых добавок, усиливающих вкус и аромат продукта, используется глутаминовая кислота (Е620), глутаминат натрия (Е621, часто называется глютамат натрия) и глутаминаты других металлов (Е622—625). Ссылки на эти вещества легко найти, например, на баночке мясного паштета. Для тех же целей применяется глицин (Е640) и лейцин (Е641).
Неверно было бы полагать, что физиологические функции выполняют только а-аминокислоты. Функционирование нервной системы связано с участием γ-аминомасляной кислоты (ГАМК). Учитель просит ребят написать структурную формулу этого вещества и пояснить, почему оно не имеет оптических изомеров.
При поступлении нервного импульса к нервной клетке она возбуждается, пропуская внутрь через каналы клеточной мембраны ионы натрия. Внутри клетки возникает избыточный положительный заряд. Для того чтобы «выключить» действие нервной клетки, необходимо компенсировать этот заряд ионами хлора. Но каналы мембраны клетки для таких ионов закрыты. Тогда на помощь приходит нейромедиатор — ГАМК. Каждый ионный канал окружен молекулами белка, встроенными в мембрану клетки. Молекулы ГАМК присоединяются к рецепторным точкам этих белковых молекул, молекулы белка изменяют свою форму и открывают ионный канал. Ионы хлора устремляются внутрь клетки, происходит торможение нервного импульса. Одним из эффектов, связанных с употреблением алкоголя, является торможение нервной активности за счет активирования действия ГАМК. Тот же принцип лежит в основе действия успокоительных лекарственных препаратов — транквилизаторов. Употребление алкоголя опасно само по себе, а в сочетании с некоторыми лекарствами (теми же транквилизаторами) особенно. Торможение нервной системы может оказаться настолько сильным, что приведет к летальному исходу.
Аминокислоты и их производные используются в качестве лекарственных средств в медицине. В аптеке можно купить глицин в таблетках. Этот препарат оказывает укрепляющее действие на организм и стимулирует работу мозга. Производимый в больших количествах лизин и метионин используется как добавка в рацион сельскохозяйственных животных. Синтетические аминокислоты — сырье для производства полиамидных синтетических волокон и изделий из этих полимеров.
Задание 1
1-й уровень
Определите молекулярную формулу аминокислоты, содержащей 32,00% углерода, 6,66% водорода, 42,67% кислорода и 18,67% азота. Напишите структурную формулу этой кислоты и назовите ее.
2-й уровень
Какое количество вещества и сколько молекул содержится в 10,5 г серина?
Задание 2
1-й уровень
При взаимодействии 89 г α-аминопропионовой кислоты с гидроксидом натрия образовалась соль массой 100 г. Рассчитайте массовую долю выхода соли.
2-й уровень
Какой объем аммиака потребуется для превращения 27,8 г бромуксусной кислоты в глицин, если объемная доля потери аммиака составляет 5%?