Настольная книга учителя химии 10 класс - поурочные разработки
БЕЛКИ И ПЕПТИДЫ - АЗОТСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
Цели урока. Дать понятие о белках и пептидах на основе межпредметных связей с биологией. Рассмотреть строение, химические свойства и биологические функции белков. В связи с валеологией дать характеристику белкам, как важнейшим составным частям пищи.
Оборудование: растворы NaOH, CuSО4, (СН3СОО)2Рb, яичного белка, (NH4)2SO4 (насыщ.), азотная кислота (конц.), аптечный препарат фестал, мясной бульон. Демонстрационные образцы: бутылка или этикетка лимонада с подсластителем Е951, молоко, яйцо вкрутую.
I. Понятие пептидов, их строение и свойства
Учитель начинает урок с проверки домашнего задания. Важнейшим свойством аминокислот являются реакции конденсации. Учитель просит написать на доске уравнение взаимодействия глицина с аланином:
Группа атомов —СО—NH—, с помощью которой связаны две α-аминокислоты, называется пептидной связью, а продукт реакции — дипептидом. (Кстати, возможно образование изомерного дипептида. Какова его формула?) Дипептид, как и аминокислота, обладает свободными аминогруппой и карбоксильной группой. Следовательно, он способен конденсироваться со следующей молекулой аминокислоты. Учащиеся сами формулируют определение полипептидов.
Пептидами называются органические соединения, содержащие два или более остатка α-аминокислот, связанных между собой пептидной связью.
По числу остатков аминокислот в молекуле различают дипептиды, трипептиды и так далее вплоть до полипептидов.
Полимерная цепь пептидной молекулы представляет собой чередование пептидных связей с атомами углерода, содержащими аминокислотные остатки R. В 1901-1902 гг. это впервые экспериментально доказал выдающийся немецкий ученый, лауреат Нобелевской премии Эмиль Фишер (тот самый, который предложил проекционные формулы углеводов).
Пептидный фрагмент является плоским: углерод карбонильной группы, азот и связанные с ними четыре атома лежат в одной плоскости. Валентные утлы при sр2-гибридном углероде близки к 120°, при sр2-углероде — 110°.
Изображать молекулу пептида удобно с помощью буквенных обозначений аминокислот. Слева изображают остаток аминокислоты, сохранившей аминогруппу, а справа — аминокислоту с незамещенным карбоксилом. Например, формула дипептида, написанная на доске кем-то из учеников, будет выглядеть так: Н2N—Glу—Аla—COOН. Загружать детей астрономическими цифрами возможных комбинаций аминокислот в полипептидах не всегда целесообразно, однако учитель должен обладать этой информацией. Действительно, число пептидов, которые могут быть образованы из 20 природных аминокислот, огромно. Теоретически можно получить 20n пептидов, содержащих п остатков. Таким образом, может существовать 400 дипептидов, 8000 трипептидов и т. д. При n = 62 число возможных пептидов превосходит число атомов во Вселенной (1080).
В живых организмах синтез пептидов происходит из аминокислот при участии ферментов. Аминокислоты же поступают с пищей или синтезируются самим организмом.
Синтез пептидов возможен и искусственным путем. Первое упоминание об этом относится к 1881-1884 гг., когда немецкий химик Теодор Курциус предложил метод синтеза «биуретовых оснований» из производных аминокислот. Ученому не удалось расшифровать строение полученных соединений, которые, как выяснилось впоследствии, оказались пептидом. Начало целенаправленному синтезу полипептидов положил Э. Фишер, получивший в 1907 г. октадекапептид с молекулярной массой 1213.
Искусственное получение природных полипептидов также возможно. Для этого необходимо знать, какие аминокислоты входят в состав молекулы, сколько аминокислот каждого вида в полимерной цепи, в какой последовательности они связаны между собой.
Выдающимся достижением органической химии стал синтез окситоцина. Этот гормон пептидной природы, стимулирующий выделение молока молочными железами, состоит из остатков 9 аминокислот. Выдающемуся американскому биохимику Винсенту Дю Виньо, всю свою жизнь посвятившему изучению гормонов, витаминов и антибиотиков, в 1932 г. удалось установить структуру окситоцина, а в 1954 г. осуществить его полный синтез из отдельных аминокислот. За эти исследования ему в 1955 г. была присуждена Нобелевская премия.
Более простые пептиды в настоящее время синтезируют химическим или микробиологическим путем. Например, в качестве синтетического заменителя сахара в пищевой промышленности широко используется вещество, называемое аспартам. На этикетках с дешевыми газированными напитками он обозначается кодом Е951 (его добавляют также в жевательную резинку). По химическому строению аспартам представляет собой дипептид, образованный аспарагиновой кислотой и метиловым эфиром фенилаланина:
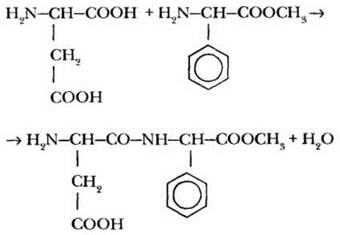
Это вещество в 300 раз слаще сахара! Однако при гидролизе в организме оно образует фенилаланин, нежелательный при некоторых заболеваниях или нарушении обмена веществ. Поэтому более дорогие напитки («Фанта», «Спрайт», «Фруктайм») подслащивают сахарозой.
Пептиды являются предшественниками более сложных природных веществ — белков, однако сами по себе также играют важную роль в природе. Например, один из простейших пептидов — трипептид глутатион H2N—Gln—Cys—Gly—СООН — встречается в большинстве живых клеток и относится к классу гормонов, т. е. биологически активных веществ, участвующих в регуляции функций живого организма. Нонапептид вазопрессин представляет собой гормон, вырабатываемый задней долей гипофиза, он участвует в регулировании кровяного давления. Гормон соматостатин (14 остатков аминокислот) содержится в гипоталамусе, поджелудочной железе, желудочно-кишечном тракте. Он подавляет секрецию гипофизом гормона роста соматотропина, в результате чего взрослый человек прекращает расти.
II. Понятие и история исследования белков
Первый белок, очищенный от примеси соединений другой природы, был получен в 1728 г. Я. Беккари. Это был белок пшеничного зерна, называемый клейковиной. Вскоре было обнаружено, что сходные соединения находятся во всех органах не только растений, но и животных. Этот факт очень удивил ученых, привыкших делить вещества на соединения «животного и растительного мира». Общим свойством новых веществ оказалось то, что при нагревании они выделили «летучие щелочи», то есть вещества основного характера — аммиак и амины. В первой половине XIX в. выяснилось, что белки составляют неотъемлемую часть всех без исключения живых веществ на Земле. Их уважительно стали именовать протеинами от греческого словаprotos — первый.
После разработки в начале XIX в. методов элементного анализа органических веществ стало известно, что в состав белков помимо углерода, водорода и кислорода входят азот, сера, фосфор и даже некоторые металлы. Открытие аминокислот, а также исследование свойств и методов получения пептидов явилось предварительной ступенькой к установлению структуры белковых молекул.
В начале XX в. Э. Фишер предположил, что белки представляют собой линейные нитевидные полимеры с молекулярной массой 4000-5000. Это оказалось верным лишь отчасти. Полимерная цепочка белка не нитевидна, а свернута в клубок или более сложное образование, а ее молекулярная масса значительно больше.
Во время Второй мировой войны и сразу после нее исследования белков получили новый стимул: среди веществ этого класса были открыты физиологически активные соединения — антибиотики, гормоны. Ученые научились сцеплять между собой 100 и более аминокислотных остатков. Проблема состояла в том, что это были остатки либо одной аминокислоты, либо многих, но в хаотической последовательности. С 50-х гг. появилась возможность получить полипептид заданного строения. Синтетическая химия опередила химию аналитическую: чтобы синтезировать природную белковую молекулу, надо точно знать последовательность аминокислот в ее цепи.
С 1945 г. английский биохимик Фредерик Сенгер приступил к изучению природного белка инсулина. Этот гормон поджелудочной железы регулирует в организме содержание глюкозы в крови. Нарушение синтеза инсулина приводит к сбою углеводного обмена и тяжелому заболеванию — сахарному диабету. Воспользовавшись всеми доступными ему методами и проявив огромное искусство, Сенгер расшифровал строение инсулина. Оказалось, что он состоит из двух полипептидных цепей дайной 21 и 30 остатков аминокислот, соединенных между собой в двух местах дисульфидными мостиками цистеиновых фрагментов. Филигранная работа потребовала долгих девять лет, но была вознаграждена Нобелевской премией по химии. На основе открытия Сенгера в 1963 г. был завершен первый синтез инсулина из отдельных аминокислот. Это был триумф синтетической органической химии!
Триумф этот несколько омрачался выходом конечного продукта: он составлял всего 0,02-0,07%. Стало понятно, что количественное получение искусственного белка в практических целях проблематично. Выход из создавшегося положения нашел американский химик-биоорганик Роберт Брюс Меррифилд. Он открыл принципиально новый метод синтеза белков на твердом полимерном носителе. Полипептидные цепи растут на поверхности полимера, как волосы на голове, только удлиняются с кончиков, а не у корней. В 1969 г. Меррифилд получил сразу несколько полипептидов: брадикинин (гормон, сосудорасширяющее действие, сокращение гладкой мускулатуры), ангиотензин (гормон, повышение кровяного давления, регуляция функции почек), рибонуклеазу (фермент, катализирует гидролиз РНК). Метод Меррифилда позволил не только получить конечный продукт с невиданными до тех пор выходами, но и на основе автоматизации процесса наладить промышленное производство полипептидов.
III. Структура белков
При первом знакомстве с белками в 9-м классе упоминалась лишь первичная структура белковых молекул. В 10-м классе само собой напрашивается проведение интегрированного урока химии-биологии на тему «Структура и функции белков, их биологическое значение». Учителя подробно останавливаются на определяющем значении первичной структуры белковой молекулы, различных вариантах свертывания полимерной цепи в Оспираль или складчатый лист (вторичная структура), образовании глобул или волокон, отличающих глобулярные белки от фибриллярных (третичная структура). Поскольку иллюстративное сопровождение материала очень сложно, учителю заранее придется позаботиться о плакатах, слайдах, кодограммах, программном компьютерном обеспечении, в зависимости от того, какими техническими средствами располагает кабинет химии или биологии. Объяснения учителя (в дополнение к материалу учебника) предлагаем провести по следующему сценарию.
Подобно полипептидам, молекулы белков представляют собой длинные цепи, состоящие из остатков α-аминокислот, связанных между собой пептидными связями. Структуру этих гигантских молекул можно рассматривать на нескольких уровнях.
Первичная структура белка — это последовательность аминокислот в полипептидной цепи. В полимерную молекулу входят остатки тех же двадцати с небольшим природных α-аминокислот, из которых состоят полипептиды. Число аминокислотных звеньев в молекуле может колебаться от нескольких десятков до сотен тысяч. Это отражается на молекулярной массе белков, изменяющейся в широких пределах: от 6500 (инсулин) до 32 миллионов (белок вируса гриппа).
На основании определения молекулярной массы и элементного состава белка можно установить общую формулу белковой молекулы. Например, формула гемоглобина крови, осуществляющего перенос кислорода от легких к клеткам тканей, (C738H1166N203O208S2Fe)4.
Первичная структура белковой молекулы играет чрезвычайно важную роль. Изменение только одной аминокислоты на другую может привести либо к гибели всего организма, либо к появлению совершенно нового вида. Замена одного остатка аминокислоты глутамина на валин в молекуле гемоглобина (содержащего 574 аминокислотных группы!) приводит к тяжелейшему заболеванию анемии, приводящему к смертельному исходу.
Изучение последовательности аминокислот в белках используют для выяснения вопроса эволюции в новой области науки — химической палеогенетике. Молекула гемоглобина лошади отличается от соответствующего белка человека в 26 местах, свиньи — в 10 местах, а гориллы — всего лишь в одном месте. Удачная замена аминокислотного остатка в белке, повышающая шансы на выживание вида, может произойти в среднем один раз за 10 миллионов лет.
Вторичная структура белка. В пространстве полипептидная цепь белка может располагаться двумя способами. Она может быть закручена в спираль, на каждом витке которой располагается 3,6 звена аминокислот с обращенными наружу радикалами. Отдельные витки скреплены между собой водородными связями между группами NH и СО различных участков цепи (рис. 42). Такая структура белка называется α-спираль и наблюдается, к примеру у α-кератина (шерсть, волосы, рога, ногти).
Если боковые группы аминокислотных остатков не очень велики (глицин, аланин, серии), две полипептидных цепи могут быть расположены параллельно и скрепляться между собой водородными связями. При этом полоса получается не плоской, а складчатой. Это P-структура белка, характерная, например, для фиброина шелка (см. рис. 42).
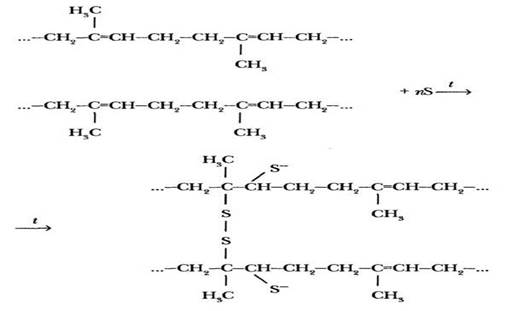
Рис. 42. Вторичная структура белка: α-спираль (а) и β-структура (б)
Третичная структура — это способ расположения α-спирали или β-структуры в пространстве. Белковая молекула свернута в клубок — глобулу, которая сохраняет пространственную форму за счет дисульфидных мостиков —S—S—. Эти мостики образуются между двумя остатками цистеина различных участков цепи. На рисунке 43 представлена третичная структура молекулы фермента гексакиназы, катализирующего спиртовое брожение глюкозы. Хорошо видно углубление в глобуле, с помощью которого белок захватывает молекулу глюкозы и где она претерпевает дальнейшие химические превращения.
Рис. 43. Третичная структура (глобула) белка гексакиназы хлебопекарных дрожжей
Четвертичная структура белка. Некоторые белки (например, гемоглобин) представляют собой сочетание нескольких белковых молекул с небелковыми фрагментами, называемыми простетическими группами. Такие белки именуются сложными или протеидами. Строение протеида и представляет собой четвертичную структуру белка.
Физические свойства белков определяются тем, к какому классу они относятся. Молекулы фибриллярных белков вытянуты в длину, нитеобразны и склонны группироваться одна возле другой с образованием волокон. Это основной строительный материал тканей: сухожилий, мускульных и покровных тканей. Такие белки в воде не растворимы. Прочность белковых молекул просто поразительна! Человеческий волос прочнее меди и может соперничать со специальными видами стали. Пучок волос площадью 1 см2 выдерживает вес в 5 тонн, а на женской косе в 200 тыс. волосинок можно поднять груженый КАМАЗ весом 20 т.
Глобулярные белки свернуты в клубочки. В организме они выполняют ряд биологических функций, требующих их подвижности и, следовательно, растворимости. Поэтому глобулярные белки растворимы в воде либо растворах солей кислот или оснований. Из-за большого размера молекул образующиеся растворы являются коллоидными.
IV. Химические свойства белков
При рассмотрении химических свойств белков учитель получает возможность украсить объяснение материала демонстрационным экспериментом.
1. Денатурация. При нагревании, под действием сильных кислот или оснований, солей тяжелых металлов и некоторых других реагентов происходит необратимое осаждение (свертывание) белков, называемое денатурацией. Крайняя легкость денатурации многих белков очень затрудняет их изучение. При денатурации происходят изменения во вторичной и третичной структуре белка, а первичная структура сохраняется. При этом их биологические функции полностью уничтожаются. В некоторых случаях возможен и обратный процесс, он называется пептизация белка. А ведь мы до сих пор не говорили об этимологии термина пептид. Оказывается, в переводе с греческого peptos означает сваренный. Это слово как раз и отражает первое свойство белка — свертывание при нагревании.
Учитель задает ребятам вопрос: к каким продуктам в быту мы применяем термин «свернуться»? Это белок куриного яйца и, конечно, молоко. На уроке можно продемонстрировать оба эти опыта или какой-либо один. При небольшом нагревании в пробирке раствора яичного белка (альбумина) содержимое белеет и образуются сгустки неправильной формы: свернувшийся белок. Большинство белков свертывается при температуре до 100 °С. Именно поэтому все живое гибнет в огне, практически все — при кипячении в воде, в привычной для нас форме невозможна жизнь на «горячих» планетах Солнечной системы (кстати, какие две планеты расположены к Солнцу ближе, чем Земля? Меркурий и Венера).
В пробирку с молоком учитель добавляет несколько капель насыщенного раствора сульфата аммония (сильный электролит вызывает денатурацию белка). В осадок выпадают белые хлопья, представляющие собой денатурированный белок молока — казеин. Подобным образом получают творог — богатый белком пищевой продукт.
2. Гидролиз. Под действием ферментов, а также водных растворов кислот или щелочей происходит разрушение первичной структуры белка в результате разрыва пептидных связей. Гидролиз приводит к образованию пептидов и аминокислот. Гидролиз — основа процесса пищеварения. В организм человека ежедневно должно поступать с пищей 60-80 г белка. В желудке под действием ферментов (из группы пептидаз) и соляной кислоты белковые молекулы «разбираются» по кирпичикам-аминокислотам. Попадая в кровь, они разносятся по всем клеткам организма, где участвуют в строительстве собственных белковых молекул, свойственных только данному виду.
Продемонстрировать модель процесса пищеварения на уроке нельзя из-за недостатка времени, а вот посвятить этому лабораторную работу в профильных классах вполне реально. В две пробирки наливают по 2 мл раствора куриного белка, в одну из них добавляют 1 мл раствора фермента. В качестве такового можно использовать насыщенный раствор аптечного препарата фестал (таблетку предварительно освободить от гладкой облатки). Фестал представляет собой ферментативный препарат, облегчающий пищеварение. В его состав входят ферменты липаза (расщепляет жиры), амилаза (расщепляет углеводы), протеаза (гидролизует белки). Обе пробирки помещают в водяную баню при температуре человеческого тела — 37-40 °С. В течение 30 мин. продолжается процесс «переваривания» белка. По окончании нагревания в обе пробирки добавляют по 2 мл насыщенного раствора сульфата аммония. В первой (контрольной) образуется обильный белый осадок: белок денатурирует. Во второй таких изменений не наблюдается: белок гидролизовался, а аминокислоты и пептиды с небольшой молекулярной массой не свертываются.
3. Качественные реакции на белки.
1) Биуретовая реакция. При действии на белки раствора солей меди (II) в щелочной среде возникает сиреневое или фиолетовое окрашивание. К равным объемам раствора белка (можно использовать мясной бульон) и гидроксида натрия учитель добавляет несколько капель раствора сульфата меди (II). Голубая окраска раствора соли меди изменяется на фиолетовую (или несколько иную в зависимости от природы белка) за счет образования комплексных соединений.
2) Ксантопротеиновая реакция. При действии на белки концентрированной азотной кислоты образуется желтая окраска, связанная с нитрованием ароматических колец в соответствующих аминокислотах. Если биуретовая реакция универсальна на все белки, то ксантопротеиновую дают только те полипептиды, которые содержат остатки фенилаланина, триптофана, тирозина. Таких аминокислот много в белках мышечных тканей (миозин), но почти нет в соединительных (желатин). Если на скорлупу вареного вкрутую яйца нанести несколько капель концентрированной азотной кислоты, происходит бурное вспенивание. Скорлупа состоит главным образом из карбоната кальция. Разрушая скорлупу, кислота проходит до белка. После промывания яйца под струей воды освободите его от остатков скорлупы. В месте попадания азотной кислоты осталось желтое пятно. Его окраска усилится и перейдет в оранжевую, если вырезанный фрагмент белка с пятном опустить в раствор щелочи или аммиака (нитроарен переходит в ацинитроформу).
Учитель, давая детям отдохнуть, переключает их внимание. Знают ли они, как отличить яйцо, сваренное вкрутую, от сырого? Если крутнуть вареное яйцо на столе, оно долго и с удовольствием будет вращаться. Сырое же покачается и быстро остановится. При варке яйцо никогда не лопнет, если в его тупом конце проколоть иголкой маленькую дырку. Его даже в кипяток опускать можно.
4. Качественное определение серы в белках. При горении белки издают характерный запах «жженого рога» (дети говорят — горелых мух). В этом легко убедиться, если поджечь шерстяную нитку или пучок волос. В значительной степени этот запах определяется содержанием в белках атома серы (цистеин, метионин, цистин). Химически доказывают наличие в белках этого элемента следующим образом. К раствору белка добавляют равный объем щелочи, нагревают до кипения и добавляют несколько капель раствора ацетата свинца. Выпадение черного осадка свидетельствует о присутствии в полученном растворе сульфид-аниона:
![]()
V. Белки как компонент пищи
В «Настольной книге учителя химии» 9-го класса мы уже приводили ряд сведений по пищевой ценности белка. Поскольку это последний из изучаемых основной компонент пищи после жиров и углеводов, настало время сделать ряд обобщений.
При переваривании в желудочно-кишечном тракте органических веществ, входящих в состав пищевых продуктов, выделяется энергия. Энергетическая ценность белковой пищи невелика и уступает жирам и углеводам. Однако это единственный источник незаменимых аминокислот в организме. В сутки человеку необходимо потреблять такое количество пищи, которое дает 1500-2000 килокалорий энергии. В настоящее время контроль за этой цифрой установили для себя многие: спортсмены, артисты, модницы, люди, страдающие различными заболеваниями или избыточным весом. Поэтому на этикетках пищевых продуктов часто указана их энергетическая ценность. А если это продукты без упаковки (овощи, рыба, мясо, хлеб)? Или наши кулинарные способности позволяют приготовить из набора продуктов новое блюдо? Существует несметное число таблиц и памяток, позволяющих рассчитать число «съеденных» калорий. Вот краткая выдержка из них.
Энергетическая ценность 100 г продукта, ккал
|
1. Салат «Оливье» |
300 |
|
2. Судак |
80 |
|
3. Селедка |
200 |
|
4. Ножка курицы |
130 |
|
5. Ножка гуся |
340 |
|
6. Филе телятины |
90 |
|
7. Филе свинины |
600 |
|
8. Торт «Наполеон» |
540 |
|
9. Шоколадная конфета, 1 шт. |
80 |
|
10. Бокал десертного вина (100 мл) |
150 |
|
11. Рюмка водки (30 мл) |
235 |
Большая часть полученной энергии расходуется на совершение работы, остальная часть — на протекание эндотермических реакций в организме и поддержание температуры тела. 55 ккал в час расходуется, когда мы спим, 75 — когда сидим, 200 — когда ходим, 500 ккал в час — когда поднимаемся или спускаемся по лестнице.
Учитель обращается к классу. Не приходила ли вам в голову такая мысль. Поскольку при переваривании пищи в организме выделяется энергия, нельзя ли создать некий генератор, имитирующий пищеварение: загружаем продукты, получаем энергию? Оказывается, недавно изобретены не только такие источники энергии, но и роботы на их основе. По сообщению журнала «New Scientist» в университете Южной Флориды создан робот, получающий энергию из мяса. Его зовут Чу-Чу (от английского Chew Chew — «жевать-жевать»). Странного вида 12-колесный механизм работает на микробиологических топливных элементах. Вырабатываемые устройством ферменты расщепляют жиры, белки и углеводы, вырабатываемая энергия превращается в электричество — и робот готов к работе. Изобретатель Чу-Чу Стюарт Вилкинсон уже придумал новый термин — гастроробот. В планах изобретателя создание газонокосилок, работающих на скошенной траве. Конечно, идеальной пищей для робота в плане энергетической ценности является мясо. Но делать это нужно с большой осторожностью, а то кровожадная железяка, наделенная искусственным интеллектом, может обратить внимание на человека.
Как уже поняли ребята, белки в живом организме «собираются» из отдельных аминокислот. «Инструкция по сборке» зашифрована в еще одном виде природных биополимеров — молекулах ДНК, о которых и пойдет речь на следующем уроке.
Задание 1
1-й уровень
С помощью буквенных обозначений написать формулы изомерных дипептидов, содержащих по одному остатку глицина и аланина.
2-й уровень
Написать структурные формулы и буквенные обозначения всех возможных трипептидов, составленных из любой возможной комбинации остатков двух аминокислот: фенилаланина и глицина (8 изомеров).
Задание 2
1-й уровень
Каким образом можно отличить одежду из натуральной кожи от искусственной, шерстяную нить от лавсановой?
2-й уровень
При щелочном гидролизе 32 г дипептида образовалось только одно вещество — натриевая соль некоторой аминокислоты. Масса соли составила 44,4 г. Установить строение дипептида.