Настольная книга учителя химии 10 класс - поурочные разработки
ТИПЫ РЕАКЦИОННОСПОСОБНЫХ ЧАСТИЦ И МЕХАНИЗМЫ РЕАКЦИЙ В ОРГАНИЧЕСКОЙ ХИМИИ. ВЗАИМНОЕ ВЛИЯНИЕ АТОМОВ В МОЛЕКУЛАХ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ - ВВЕДЕНИЕ
Цели урока. В продолжение развития понятий о типах химических реакций раскрыть способы разрыва ковалентной связи в органических соединениях. Дать общее представление об электрофилах и нуклеофилах. Начать формирование понятия о мезомерном и индуктивном эффектах как о проявлении взаимного влияния атомов в молекулах. Познакомить учащихся с механизмами органических реакций.
I. Способы разрыва ковалентной связи в органических соединениях
Учитель еще раз просит учащихся вспомнить особенности строения органических веществ. Он обращает внимание на то, что наиболее характерна для органических соединений ковалентная связь и молекулярное строение. Затем проводится беседа по вопросам:
— какая связь называется ковалентной?
— что такое общая электронная пара?
— каков механизм образования общей электронной пары?
— какие разновидности ковалентной связи вы знаете?
— чем отличается ковалентная полярная связь от неполярной?
— что такое σ-связь?
— за счет перекрывания каких орбиталей может образовываться σ-связь?
— какая связь называется π-связью?
— орбитали какого типа могут образовывать π-связь?
С помощью учителя ребята вспоминают, что существует два способа образования ковалентной связи: обменный и донорно-акцепторный. Первый предполагает обобществление по одному неспаренному электрону каждого атома. По второму способу один атом (донор) поставляет для образования связи неподеленную пару электронов, а второй (акцептор) - свободную (вакантную) орбиталь. В обоих случаях результат один: атомы вступают в ковалентную связь за счет образования общей электронной пары.
Сущность любой химической реакции заключается в образовании новых молекул из тех же самых атомов, из которых образованы исходные вещества. Следовательно, одни связи должны разорваться, другие - образоваться. Формально разрыв ковалентной химической связи - это процесс, обратный ее образованию.
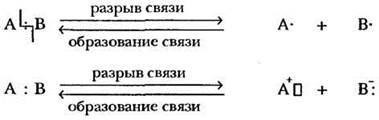
Как следует из схемы, в результате разрыва связи могут образовываться как частицы с неспаренным электроном (атомы или радикалы), так и заряженные частицы — ионы (катионы или анионы). В первом случае общая пара электронов «поровну» делится между связанными атомами. Такой разрыв называется гомолитическим. Во втором случае оба электрона ковалентной связи остаются у одного атома, атома более электроотрицательного элемента. Это гетеролитический разрыв связи.
II. Типы реакционноспособных частиц в органической химии
Учитель подчеркивает, что, как правило, осколки молекулы (радикалы и ионы), образующиеся после разрыва связи, живут очень короткое время. Они стабилизируются, образуя связи с другими атомами и группами, т. е. проявляют высокую реакционную способность. Однако эти реакционноспособные частицы в прямом смысле разборчивы в своих связях. Для стабилизации радикала им нужна частица с неспаренным электроном. Анион или атом с неподеленной парой электронов ищет для образования связи атом с вакантной орбиталью. Катиону необходим «партнер» с избытком электронной плотности. На основании этого все реагенты в органической химии делятся на три группы:
R· — радикальный реагент (радикал);
А+ — элетрофильный реагент (элеткрофил), электро + фил = любящий электрон, отрицательный заряд;
В:- - нуклефильный реагент (нуклеофил), нуклеос + фил = любящий протон, положительный заряд.
На ребят обрушился большой объем новой информации и терминологии. Прежде чем двигаться дальше, необходимо закрепить материал. Это можно сделать путем решения несложных заданий.
Задание 1. Среди указанных частиц определите радикальные, электрофильные и нуклеофильные реагенты:
![]()
Задание 2. Определите реагент и его тип, а также способ разрыва связи в субстрате.
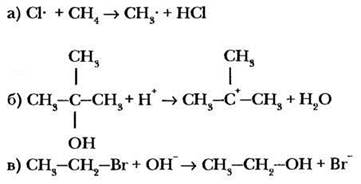
III. Взаимное влияние атомов в молекулах органических соединений
Учитель просит ребят назвать основные положения теории строения органических соединений А. М. Бутлерова и актуализирует, что на этом этапе урока будет более детально рассмотрено 3-е положение — о взаимном влиянии атомов в молекуле.
В одной из научных статей в 1863 г. Бутлеров писал: «Атомы водорода, соединенные с углеродом, ведут себя относительно реагентов... иначе, чем соединенные с кислородом». Учитель иллюстрирует это положение примером.
Молекулярная формула метилового спирта СН4O. Три атома водорода в молекуле этого вещества связаны с углеродом, а один — с атомом кислорода, что наглядно демонстрирует структурная формула:
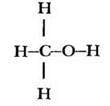
Очевидно, что три атома водорода метильной группы в химических реакциях будут вести себя иначе, чем водород гидроксильной группы. Развить мысль дальше помогают ребята. Какой тип связи между атомами в молекуле метанола? Ковалентные полярные. Какой из трех элементов наиболее электроотрицателен, а какой — наименее? Соответственно кислород и водород. Какая связь в молекуле является самой полярной? Связь О—Н, поскольку разность электроотрицательностей этих элементов максимальна. Смещение электронной плотности вдоль линии σ-связей в молекуле называют индуктивным эффектом и часто изображают стрелками:
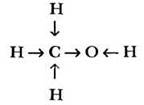
Учитель предлагает рассмотреть молекулу метилового спирта как сочетание двух групп: метильной и гидроксильной. Обе группы оказывают друг на друга определенное влияние. Каким образом? За счет полярности связи между ними. Гидроксильная группа притягивает к себе электронную плотность ковалентной связи. Такое влияние называется отрицательным индуктивным эффектом и обозначается -I. Метальная группа подает электронную пару более электроотрицательному кислороду, т. е. обладает положительным индуктивным эффектом (+I). В результате на атоме кислорода образуется частичный отрицательный заряд, на атоме углерода - частичный положительный.
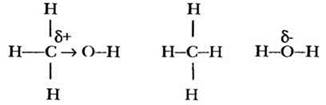
В метане по сравнению с метанолом атом углерода не имеет заряда δ+, поскольку атом водорода не обладает отрицательным индуктивным эффектом. Величина заряда δ- на атоме кислорода в воде меньше, чем в метиловом спирте, так как отсутствует +I - эффект метильной группы.
Индуктивный эффект быстро затухает в цепочке атомов. Например, отрицательный индуктивный эффект гидроксильной группы мало сказывается на электронном состоянии дальнего атома углерода в этиловом спирте:
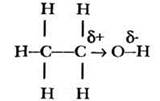
Вместе с тем существуют электронные эффекты, распространяющиеся на большее число атомов в цепочке. Такие эффекты называются мезомерными, они связаны со смещением электронной плотности кратных связей или неподеленных пар электронов.
На примере хлорэтена учитель объясняет понятие положительного мезомерного эффекта (+М). Атом хлора более электроотрицателен, чем атом углерода, он обладает отрицательным индуктивным эффектом (-I). Вместе с тем у хлора имеется неподеленная пара электронов на p-орбитали. В непосредственной близости с атомом хлора расположена двойная связь. В результате отталкивания от р-электронов галогена электронная плотность двойной связи смещается к дальнему углеродному атому. Такой эффект атома хлора называется положительным мезомерным.
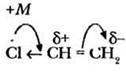
В результате положительного мезомерного эффекта хлора двойная связь поляризуется, что определяет ее реакционную способность, например, в реакциях присоединения.
Существуют также функциональные группы, обладающие отрицательным мезомерным эффектом (-М).
Вопрос о типах электронных эффектов в органической химии очень сложен для учащихся и на раннем этапе изучения предмета усваивается с трудом, поэтому не следует добиваться полного понимания всех тонкостей вопроса. Методическая целесообразность введения данных понятий связана с тем, что при последующих обращениях к этому вопросу (правило Марковникова в алкенах, ориентация электрофильного замещения в ароматическом кольце, сравнение силы карбоновых кислот) первичные знания об индуктивных и мезомерных эффектах наполняются все новым и новым содержанием и тем самым лучше усваиваются.
IV. Понятие о механизме химической реакции
Урок, посвященный рассмотрению механизмов реакций в органической химии, учитель начинает с повторения вопроса о типах реакций и реакционных частиц. Учащиеся вспоминают понятия реакций замещения, присоединения, элиминирования, классифицируют реакционные частицы на радикальные, нуклеофильные и электрофильные. В любой химической реакции происходит разрыв одних химических связей и образование других. Связь в исходном соединении (субстрате) может разрываться под действием:
— реагента;
— температуры;
— электромагнитного излучения.
В зависимости от того, какие реакционные частицы участвуют в процессе и что происходит с субстратом, различают несколько основных механизмов реакций в органической химии, они перечислены в учебнике. Строго говоря, под механизмом понимают последовательность отдельных стадий протекания реакции с указанием промежуточных частиц, образующихся на каждой из этих стадий. При изучении отдельных классов веществ некоторые из названных механизмов будут рассмотрены подробно. На данном уроке учителю Достаточно пояснить, что реакции радикального замещения или присоединения происходят под действием свободных радикалов, нуклеофильные реакции - с участием нуклеофильных реагентов, а электрофильные предполагают начальную атаку субстрата электрофилом.
Для закрепления материала рекомендуется отрабатывать новые понятия с использованием уравнений реакций, написанных учителем.
Задание. Даны три реакции:
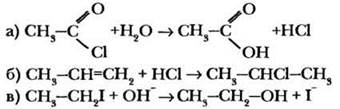
1. Определите тип каждой реакции.
2. Укажите две-три (1-й уровень) или четыре (2-й уровень) электрофильные частицы.
3. В каждой реакции определите субстрат и реагент.
4. Каков механизм каждой реакции?