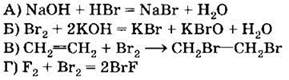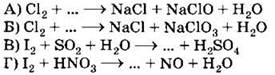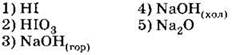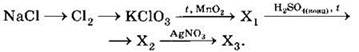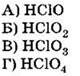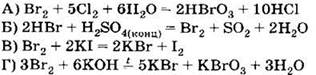Химия 11 класс - контрольные и проверочные работы к учебнику О. С. Габриелян - 2016 год
Галогены
ВАРИАНТ 1
Часть А. Тестовые задания с выбором одного правильного ответа
А1. Атомам галогенов соответствует конфигурация внешнего электронного уровня
1) ns2nps
2) ns2np4 .
3) ns2np5 .
4) ns2np6
A2. В ряду химических элементов F — Сl — Вr — I
1) число электронных энергетических уровней атомов не изменяется
2) радиус атомов увеличивается
3) электроотрицательность увеличивается
4) окислительная способность образованных элементами простых веществ возрастает
А3. Природным минералом, содержащим натрий и калий, является
1) флюорит .
2) пирит
3) сильвинит .
4) корунд
А4. В перечне веществ

только восстановительные свойства за счёт атомов галогенов могут проявлять соединения
1) АБВ
2) БДЕ
3) ГДЕ .
4) ВГД
А5. Бром проявляет восстановительные свойства при взаимодействии с
1) сероводородо.
2) алюминием
3) иодидом кали.
4) хлором
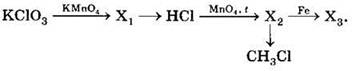
А6. В схеме превращений
![]()
веществами Х1 и Х2 соответственно являются
![]()
А7. Хлорид натрия можно отличить от иодида натрия с помощью
1) разбавленной серной кислоты
2) раствора нитрата серебра
3) лакмуса
4) раствора нитрата бария
А8. В таблице представлены значения констант диссоциации KR кислот, образованных галогенами.
|
Формула кислоты |
HF |
HClO |
НВrО |
НIO |
|
КД |
6,31 ∙ 10-4 |
3,98 ∙ 10-8 |
2,82 ∙ 10-9 |
3,16 ∙ 10-11 |
Наибольшее значение pH будет иметь 0,01 М раствор соли
1) NaF
2) NaClO
3) NaBrO
4) NaIO
A9. Какие из утверждений о галогенах и их свойствах верны?
А. Простые вещества—галогены в твёрдом состоянии имеют молекулярные кристаллические решётки.
Б. С щелочными металлами галогены образуют соединения с ионным типом связи.
1) верно только .
2) верно только Б
3) верны оба суждения
4) неверны оба суждения
А10. Объём кислорода (н. у.), образующегося при нагревании 24,5 г хлората калия в присутствии оксида марганца (IV), равен
1) 2,24 л
2) 3,36 л
3) 4,48 л
4) 6,72 л
Часть В. Тестовые задания с выбором трёх правильных ответов (В1) и на соответствие (В2 и В3)
В1. Для фтора справедливы утверждения
1) может быть получен путём электролиза раствора фторида натрия
2) имеет высшую степень окисления, равную +7
3) диспропорционирует в растворах щелочей
4) проявляет в реакциях только окислительные свойства
5) реагирует с инертным газом ксеноном
6) взаимодействует с золотом и платиной
В2. Установите соответствие между формулой кислоты и названием соответствующей ей соли.
|
ФОРМУЛА КИСЛОТЫ
|
НАЗВАНИЕ СОЛИ 1) хлорид 2) хлорит 3) хлорат 4) гипохлорит 5) перхлорат |
В3. Установите соответствие между уравнением реакции и свойством элемента брома, которое он проявляет в этой реакции.
|
УРАВНЕНИЕ РЕАКЦИИ
|
СВОЙСТВО БРОМА 1) окислитель 2) восстановитель 3) и окислитель, и восстановитель 4) не проявляет окислительно-восстановительных свойств |
Часть С. Задания с развёрнутым ответом
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения с участием хлора и его соединений:
С2. Хлор, полученный в результате взаимодействия 31,6 г перманганата калия с избытком концентрированной соляной кислоты, пропустили через горячий 16,26%-й раствор гидроксида калия объёмом 359,4 мл с плотностью 1,15 г/мл. Определите массовые доли веществ в растворе после окончания реакции.
ВАРИАНТ 2
Часть А. Тестовые задания с выбором одного правильного ответа
А1. Природным минералом, содержащим фтор, является
1) флюорит .
2) гали.
3) малахит .
4) кварц
А2. Галогенид-ионам соответствует конфигурация внешнего электронного уровня
1) ns2np5
2) ns2np4
3) ns2np6
4) ns2 А3. В перечне веществ окислительно-восстановительную двойственность за счёт атомов галогенов могут проявлять соединения 1) АБВ 2) БВЕ . 3) ГДЕ . 4) АГД А4. В ряду простых веществ — галогенов уменьшается 1) температура кипения 2) температура плавления 3) интенсивность окраски 4) окислительная способность А5. И хлор, и иод способны реагировать с 1) бромидом кали. 2) гидроксидом кали. 3) азотом 4) кислородом А6. В схеме превращений веществами Х1 и Х2 соответственно являются А7. Наиболее сильной кислотой является 1) хлорноватиста. 2) хлористая 3) хлорноватая. 4) хлорная А8. Фторид натрия можно отличить от иодида натрия с помощью раствора 1) хлороводородной кислоты 2) нитрата кальция 3) сульфата калия 4) гидроксида калия А9. Какие из утверждений о галогенах и их свойствах верны? А. В свободном состоянии галогены образуют двухатомные молекулы. Б. Галогены обладают высокой восстановительной способностью. 1) верно только . 2) верно только Б 3) верны оба суждения 4) неверны оба суждения А10. Объем хлора (н. у.), который может полностью окислить железо массой 11,2 г, равен 1) 2,24 л 2) 3,36 л 3) 4,48 л 4) 6,72 л Часть В. Тестовые задания с выбором трёх правильных ответов (В1) и на соответствие (В2 и В3) В1. Для иода справедливы утверждения 1) встречается в природе в свободном состоянии 2) имеет высшую степень окисления, равную +7 3) может быть получен из раствора иодида натрия вытеснением хлором 4) обладает большей по сравнению с бромом окислительной способностью 5) реагирует с кислородом с образованием оксида иода (VII) 6) окисляется под действием концентрированной азотной кислоты В2. Установите соответствие между уравнением реакции и свойством элемента брома, которое он проявляет в этой реакции. УРАВНЕНИЕ РЕАКЦИИ СВОЙСТВО БРОМА 1) окислитель 2) восстановитель 3) и окислитель, и восстановитель 4) не проявляет окислительно-восстановительных свойств В3. Установите соответствие между схемой реакции и формулой недостающего в ней вещества. СХЕМА РЕАКЦИИ ФОРМУЛА НЕДОСТАЮЩЕГО ВЕЩЕСТВА Часть С. Задания с развёрнутым ответом С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения с участием хлора и его соединений: С2. Смесь бромида и иодида натрия общей массой 8,15 г растворили в воде и к полученному раствору прилили избыток раствора нитрата серебра. Масса полученного осадка оказалась равной 14,1 г. Определите массовые доли бромида и иодида натрия в исходной смеси.![]()
![]()
![]()
![]()