Химия 11 класс - контрольные и проверочные работы к учебнику О. С. Габриелян - 2016 год
Халькогены. Сера
ВАРИАНТ 1
Часть А. Тестовые задания с выбором одного правильного ответа
А1. Атомам халькогенов соответствует конфигурация внешнего электронного уровня
1) ns2np2
2) ns2np4
3) ns2np5 .
4) ns2np6
A2. В ряду химических элементов
О — S — Se — Те —Ро
1) число электронных энергетических уровней атомов не изменяется
2) число внешних электронов увеличивается
3) низшая степень окисления атомов уменьшается
4) неметаллические свойства ослабевают
А3. В свободном состоянии в природе существуют оба химических элемента
1) сера и теллу.
2) кислород и сера
3) селен и кислоро.
4) полоний и селен
А4. В перечне веществ
A) CaS .
Б) S8.
В) Na2Te
Г) H2SO4
Д) H2Se Е) K2SeO3 только восстановительные свойства за счёт атомов халькогенов могут проявлять соединения 1) АБД 2) АВД 3) ВДЕ 4) АГД А5. Оксид серы (IV) взаимодействует с каждым из трёх веществ, расположенных в ряду A6. В схеме превращений A7. Концентрированная серная кислота взаимодействует с каждым из трёх веществ, расположенных в ряду A8. Сульфит натрия можно отличить от сульфида натрия с помощью 1) раствора хлорида аммония 2) раствора гидроксида калия 3) лакмуса 4) соляной кислоты А9. Какие из утверждений о кислороде и его свойствах верны? А. В свободном состоянии кислород способен существовать в виде двух аллотропных модификаций. Б. Кислород взаимодействует с галогенами с образованием оксидов. 1) верно только . 2) верно только . 3) верны оба суждения 4) неверны оба суждения А10. Минимальный объём 10%-го раствора гидроксида калия с плотностью 1,08 г/мл, который необходим для поглощения сероводорода объёмом 6,72 л (н. у.), равен 1) 155,6 мл . 2) 168 мл 3) 311,1 мл . 4) 336 мл Часть В. Тестовые задания с выбором трёх правильных ответов (В1) и на соответствие (В2 и В3) В1. Для сероводорода справедливы утверждения 1) при обычных условиях — газ с характерным запахом 2) хорошо растворим в воде 3) водный раствор является сильной кислотой 4) не способен к образованию кислых солей 5) взаимодействует с концентрированной азотной кислотой 6) проявляет сильные восстановительные свойства В2. Установите соответствие между реагирующими веществами и продуктами их взаимодействия. РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ В3. Установите соответствие между уравнением реакции и свойством элемента серы, которое он проявляет в реакции. УРАВНЕНИЕ РЕАКЦИИ СВОЙСТВО СЕРЫ 1) окислитель 2) восстановитель 3) и окислитель, и восстановитель 4) не проявляет окислительно-восстановительных свойств Часть С. Задания с развёрнутым ответом С1. Составьте уравнения реакций в соответствии со схемой изменения степеней окисления атомов серы: С2. В 150 мл 20% -го раствора серной кислоты с плотностью 1,14 г/мл растворили 4 г оксида серы (VI). К полученному раствору добавили 100 мл 18%-го раствора хлорида бария с плотностью 1,18 г/мл. Определите массу выпавшего осадка и массовые доли веществ в растворе над осадком. ВАРИАНТ 2 Часть А. Тестовые задания с выбором одного правильного ответа А1. Для всех элементов VIA группы справедливо утверждение 1) являются неметаллами 2) встречаются в природе в свободном состоянии 3) содержат два неспаренных электрона на внешнем уровне 4) имеют высшую степень окисления +6 А2. В ряду химических элементов Ро — Те — Se — S — О возрастает 1) число внешних электронов 2) высшая степень окисления атомов 3) низшая степень окисления атомов 4) электроотрицательность А3. В перечне веществ только окислительные свойства за счёт атомов халькогенов могут проявлять соединения 1) АБЕ 2) ВГЕ . 3) БДЕ 4) АГД А4. Сероводород взаимодействует с каждым из трёх веществ, расположенных в ряду A5. Оксид серы (VI) взаимодействует с каждым из трёх веществ, расположенных в ряду А6. В схеме превращений A7. Концентрированная серная кислота взаимодействует с каждым из трёх веществ, расположенных в ряду А8. Сульфат натрия можно отличить от сульфита натрия с помощью 1) хлорида бария 2) хлорида калия 3) раствора гидроксида калия 4) соляной кислоты А9. Какие из утверждений о сере и её свойствах верны? А. В свободном состоянии сера способна к образованию нескольких аллотропных модификаций. Б. Сера используется для вулканизации каучука. 1) верно только . 2) верно только Б 3) верны оба суждения 4) неверны оба суждения А10. В 150 мл воды растворили 16 г оксида серы (VI). Массовая доля кислоты в полученном растворе равна 1) 9,6% . 2) 10,7% . 3) 11,8% . 4) 13,1% Часть В. Тестовые задания с выбором трёх правильных ответов (В1) и на соответствие (В2 и В3) В1. Для оксида серы (IV) справедливы утверждения 1) при обычных условиях — маслянистая жидкость без запаха 2) образуется при обжиге сульфидов 3) проявляет амфотерные свойства 4) водный раствор окрашивает лакмус в красный цвет 5) окисляется под действием концентрированной серной кислоты 6) в химических реакциях может быть как окислителем, так и восстановителем В2. Установите соответствие между схемой реакции и формулой недостающего в ней вещества. СХЕМА РЕАКЦИИ ФОРМУЛА НЕДОСТАЮЩЕГО ВЕЩЕСТВА В3. Установите соответствие между уравнением реакции и свойством элемента серы, которое он проявляет в реакции. УРАВНЕНИЕ РЕАКЦИИ СВОЙСТВО СЕРЫ 1) окислитель 2) восстановитель 3) и окислитель, и восстановитель 4) не проявляет окислительно-восстановительных свойств Часть С. Задания с развёрнутым ответом С1. Составьте уравнения реакций в соответствии со схемой изменения степеней окисления атомов серы: С2. Сернистый газ, полученный в результате полного сгорания 2,24 л (н. у.) сероводорода, пропустили через 218,6 мл 18,3%-й раствор гидроксида натрия с плотностью 1,2 г/мл. Определите массовые доли веществ в полученном растворе.![]()
![]() веществами X1 и X2 соответственно являются
веществами X1 и X2 соответственно являются![]()
![]()
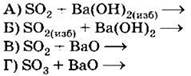
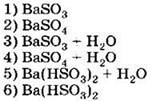
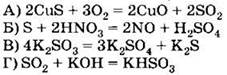
![]()
![]()
![]()
![]()
![]() веществами Х1 и Х2 соответственно являются
веществами Х1 и Х2 соответственно являются![]()
![]()
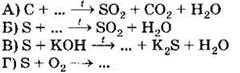

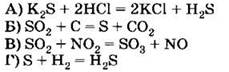
![]()