Поурочные разработки по химии 11 класс
Урок-лекция по теме «Виды химических связей. Типы кристаллических решеток» - СТРОЕНИЕ ВЕЩЕСТВА - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: углубить и расширить знания о причинах возникновения разных видов химической связи и механизмах их образования; научить характеризовать химическую связи по определенному плану; дать более полное представление о всех типах кристаллических решеток; научить соотносить зависимость физических и химических свойств веществ от вида химической связи и типа кристаллической решетки.
Основные понятия: химическая связь; виды химической связи; ковалентная, ионная, механизмы образования связи: обменный, донорно-акцепторный; электроотрицательность, степень ионности, кристаллические решетки: атомные, ионные, молекулярные; дипольный момент; σ- и π-связи; кратность связи.
Оборудование: таблица «Химическая связь»; кодотранспорант «Шкала ЭО по Полингу»; модели кристаллических решеток; эбонитовая палочка; бюретка с водой, карточки-задания (для закрепления).
Ход урока
I. Организационный момент
Учитель сообщает учащимся результаты контрольной работы; делает анализ выполнения заданий, разбирает типичные ошибки; можно предложить учащимся сделать работу над ошибками.
II. Изучение нового материала
План изложения
1. Определение химической связи. Причины образования химической связи.
2. Ионная связь. Тип кристаллической решетки соединений с ионной связью. Физические свойства веществ.
3. Ковалентная связь. Механизмы образования ковалентной связи по МВС: а) обменный; б) донорно-акцепторный.
4. Разновидности ковалентной связи; а) неполярная; б) полярная.
5. σ- и π-связи. Кратность связи.
6. Типы кристаллических решеток соединений с ковалентной связью. Физические свойства веществ.
7. Понятия «полярность связи» и «полярность молекулы».
Вопрос. Какие виды химической связи известны? А какие типы кристаллических решеток?
Ответ. Известны ковалентная связь, ионная связь, металлическая связь, водородная связь. Типы кристаллических решеток — ионная, атомная, молекулярная.
Главными задачами урока являются выяснение причин возникновения различных видов химической связи и изучение механизмов образования связи.
Вопрос. Что такое химическая связь?
Ответ. Под химической связью понимаются электрические силы притяжения, удерживающие частицы друг около друга. Частицами могут быть атомы, ионы, молекулы.
Причиной образования химической связи между частицами является стремление системы к минимуму энергии. Энергия образующейся системы — химической связи — меньше энергии, которой обладают изолированные частицы. Идет выигрыш в энергии.
Среди частиц самые устойчивые те, у которых внешний энергетический уровень завершен. Благородные газы на внешнем энергетическом уровне имеют октет электронов, у Не — 2е-. Таким образом, атомы, имеющие на внешнем энергетическом уровне меньше 8 электронов, стремятся приобрести структуру инертных газов, т. е. иметь октет электронов на внешнем энергетическом уровне.
Образование такой устойчивости может идти несколькими способами и приводит к образованию соединений с разными видами химической связи: ковалентной, ионной, металлической, водородной.
Любая химическая связь образуется только тогда, когда сближение частиц (двух или более) приводит к понижению полной энергии системы. Определяющими являются энергия взаимодействия — Е и межъядерное расстояние — r.
Важнейшим фактором характеристики атома при образовании химической связи является его электроотрицательность (ЭО) — способность притягивать электроны.
Далее необходима работа с таблицей «Шкала ЭО по Полингу» (кодотранспорант). ЭО усиливается к концу периода, к концу группы главной подгруппы.
Определение типа связи:
— если атомы обладают одинаковой ЭО, возникает ковалентная связь;
— если атомы обладают ЭО разной, но не резко отличаются, разность в ЭО < 1,7 — возникает ковалентная полярная связь;
— если атомы обладают ЭО разной, резко отличаются, разность в ЭО > 1,7 — возникает ионная связь.
По шкале ЭО по Полингу можно определить степень ионности — полярность связи: чем больше разность в ЭО, тем больше степень ионности, тем полярнее связь.
|
Разность в ЭО |
Степень ионности, % |
|
0 |
0 |
|
0,5 |
6 |
|
1,0 |
22 |
|
1,5 |
44 |
|
2,0 |
63 |
|
2,5 |
79 |
|
3,0 |
89 |
Таким образом, при разности в ЭО больше, чем 1,7, возникает ионная связь.
Ионная связь — связь за счет электростатического притяжения противоположно заряженных частиц (катионов — положительно заряженных и анионов — отрицательно заряженных). Ионная связь возникает между атомами, резко отличающимися в ЭО — типичные металлы и типичные неметаллы. Рассмотрим механизм образования ионной связи в соединении NaCl.
Это соединение образовалось между атомом Na — типичный металл, ЭОNa = 0,9, и атомом Сl — типичный неметалл, ЭОCl = 3,2.
Разность в ЭО = 2,3, следовательно, возникает ионная связь.
При взаимодействии Na с Сl2:
2Na + Cl2 = 2NaCl
в результате окислительно-восстановительной реакции образуются катионы сильно электроположительного элемента (металла) и анионы сильно электроотрицательного элемента.
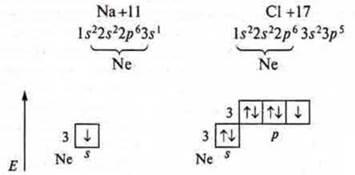
Наблюдается отдача одного s-электрона атома Na:
![]()
Возникает устойчивая частица с октетом электронов на внешнем энергетическом уровне: 1s22s22p6 — Na+, катион натрия. Атом хлора присоединяет электрон на р-подуровень:
![]()
Возникает устойчивая частица, так же с октетом электронов на внешнем энергетическом уровне — аннон хлора. Между образовавшимися ионами возникают силы электростатического притяжения, которые будут удерживать их друг около друга, осуществляется тем самым ионная связь. Она характерна для бинарных, образованных металлами и неметаллами, а также более, сложных — трехэлементных — соединений: щелочи, соли. В этом случае катионы и анионы могут быть не только простыми, но и сложными.
Пример: катион аммония — NH4+; сульфат — анион SO42-; гидроксид — анион ОН-.
Катионы и анионы, взаимодействуя друг с другом, образуют вещества в твердом состоянии с ионной кристаллической решеткой. В пространстве катионы и анионы упорядоченно располагаются. Чем меньше размер иона и чем больше его заряд, тем сильнее его электростатическое поле и тем прочнее химическая связь.
Так, энергия кристаллической решетки LiF — 1004 кДж/моль, а у NaCl — 755 кДж/моль. Все вещества с ионной кристаллической решеткой малолетучие, твердые, тугоплавкие, проводят электрический ток в растворах и расплавах. Однако кристаллы с ионной связью — ионы — очень хрупкие, т.к. при незначительном сдвиге плоскостей в кристалле наблюдается близкое приближение одноименно заряженных ионов, которые, отталкиваясь друг от друга, вызывают разрыв, появляется трещина в кристалле.
![]()
При высоких температурах многие вещества с ионной связью, например галогениды, переходят в газообразные соединения. В газовой фазе могут находиться молекулы NaCl и их агрегаты (NaCl)2 с непрочными ковалентными связями, а также ионы Na+ и Сl-.
Следует знать, что соединений с ионной связью — ограниченное количество, чисто ионная связь в соединениях не существует. В этих случаях следует говорить о степени ионности. Чем она выше, тем связь более ионная.
По мере увеличения количества электронов на внешнем энергетическом уровне атома металла усиливается прочность их связи с ядром атома, уменьшается способность к образованию ионной связи. У алюминия с галогенами возникают ковалентные связи, однако под влиянием, например, полярных растворителей эти связи становятся ионными.
Ионная связь — крайний случай ковалентной полярной связи. Что же такое ковалентная связь?
Связь посредством общих электронных пар называется ковалентной. Она возникает в случае разности в ЭО меньше 1,7, приближающейся к нулю. Если атомы обладают одинаковой ЭО — возникает ковалентная неполярная связь; если атомы обладают разной ЭО — возникает ковалентная полярная связь.
Существует два механизма возникновения ковалентной связи: обменный и донорно-акцепторный. Для обменного механизма необходимы следующие условия:
1) взаимодействующие атомы должны иметь неспаренные электроны, характеризующиеся различными спиновыми квантовыми числами:
![]()
2) в системе должна находиться частица с низким запасом энергии, которая поглощала бы энергию, выделяющуюся при образовании химической связи, т. к. образование связи — эндотермический процесс:
![]()
Частица X может быть либо А либо В с низким запасом энергии. Получив энергию, она может сама участвовать в образовании химической связи.
Данный механизм образования химической связи объясним методом валентных связей (МВС).
Пример: образование молекулы водорода Н2:
атом водорода — ![]()
атом водорода — ![]()
радиус атома Н — rн = 0,053 нм
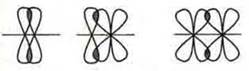
При образовании химической связи идет перекрывание АО (атомных орбиталей).
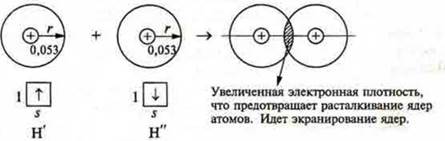
Если бы не было перекрывания орбиталей, то межъядерное расстояние было бы равно 2r = 0,053 х 2 = 0,106 (нм).
Однако в молекуле водорода это расстояние равно 0,074 нм, т.е. меньше. Следовательно, идет перекрывание орбиталей.
При сближении атомов водорода Н' и Н" силы электростатического притяжения электрона атома Н' к ядру атома Н" и электрона атома Н" к ядру атома Н' будут возрастать, начнут притягиваться друг к другу. Одновременно будут возрастать силы отталкивания между одноименно заряженными ядрами атомов Н' и Н". Это приводит к тому, что атомы могут сблизиться между собой настолько, что силы притяжения будут уравновешены полностью силами отталкивания и электронные облака начнут перекрываться между собой, что обеспечивает перемещение электрона одного атома Н' в поле притяжения ядра атома Н" и наоборот, и каждый атом в какой-то момент будет иметь завершенный внешний энергетический уровень, как у благородных газов.
Связь, осуществленная за счет образования общих электронных пар, в одинаковой мере принадлежащих обоим атомам, называется ковалентной.
Разновидности ковалентной связи:
а) неполярная ковалентная связь возникает между атомами, обладающими одинаковой ЭО.
Пример: O2; O3; N2; Сl2; Н2 и т.д.
б) полярная ковалентная связь возникает между атомами, которые различаются не резко в ЭО.
Пример: НСl, NH3, Н2O и т. д. (если позволяет время урока в классах, где учащиеся воспринимают материал более осознанно, можно объяснить понятие «дипольный момент» для объяснения полярности связи).
Дипольный момент μ есть произведение длины диполя / (расстояние между двумя равными по величине и противоположными по знаку зарядов + q и -q) на абсолютную величину заряда: μ = lq.
Дипольный момент — величина векторная и направлен по оси диполя от отрицательного заряда к положительному.
Пример:
HF, μ = 6,4 · 10-30
НСl, μ = 3,5 · 10-30
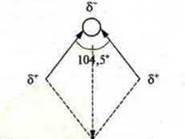
НВr, μ = 2,6 · 10-30
HI, μ = 1,3 · 10-30 Наибольший дипольный момент у фтороводорода, где F обладает большей ЭО. Молекула Н2O μ = 6,1 · 10-30. Угловое строение молекулы Молекула СO2, Каждая связь полярна и μ = 9 · 10-30, однако молекула неполярна, μ = 0, т. к. связи С=0 расположены на одной прямой и компенсируют дипольные моменты друг друга. Почему такое строение в пространстве имеют молекулы СO2 и Н2O, это вопрос следующих уроков темы. Из вышесказанного, следует различать понятия «полярность связи» и «полярность молекулы» в целом (опыт демонстрационный). В простых двухатомных молекулах дипольный момент и полярность связи равны, а в сложных соединениях Н2O, NH3, НСl, СO2 — не равны. В случаях трудности понимания дипольного момента возможно объяснение полярности связи нахождением разности в ЭО атомов, образующих соединение, а затем сделать вывод, какая связь более полярна. Пример: HF и HI Полярнее связь в соединении HF, т. к. разность в ЭО 1,9 больше 0,4. Полярная ковалентная связь есть промежуточная между ковалентной неполярной и ионной связью. Кроме обменного механизма образования ковалентной связи возможен и донорно-акцепторный механизм. Для осуществления такого механизма необходимы следующие условия: 1. В системе должны находиться две частицы. Одна — донор, имеющий неподеленную пару электронов. Такие частицы образуются в результате обменного механизма, при перераспределении электронов. Пример: 2. В системе должна находиться частица, поглощающая энергию (как и при обменном механизме). Пример: образование иона аммония. [NН4]+; аммиак NH3, N +7. 1s22s22p3 Кратность связи соответствует числу общих электронных пар. Одинарная связь — одна общая электронная пара, двойная связь — две общих электронных пары, тройная — три общих электронных пары. При осевом перекрывании орбиталей возникает прочная, неполяризуемая трудноразрываемая σ-связь (сигма-связь). При осевом перекрывании s-орбиталей σ-связь s—s: При осевом перекрывании р-орбиталей σ-связь р—р: При осевом перекрывании s-орбитали и р-орбитали; σ-связь s—р: В случае двойной или тройной связи кроме образования σ-связи (осевого перекрывания орбиталей) образуется и π-связь (пи-связь). В этом случае идет боковое перекрывание орбиталей. π-связь В случае двойной связи — одна σ-связь, другая π-связь; тройной связи — одна σ-связь и 2 π-связи. В некоторых случаях возможно нахождение связи в динамическом состоянии, т. е. электронные облака «размазаны» между двумя, тремя, четырьмя и т.д. атомами, тогда кратность связи дробная, полуторная. В бензоле С6Н6 6е- — π-облако, связь полуторная, если одинарная связь имеет длина 0,154 нм, двойная связь — 0,134 нм, то в ароматическом кольце ее длина — 0,140 нм. Все вещества с ковалентной связью как правило при обычных условиях могут быть жидкостями, газами, твердыми по агрегатному состоянию; низкоплавкие, летучие. Они могут образовывать два типа кристаллических решеток. Атомные кристаллические решетки — в узлах кристаллической решетки — атомы, между которыми ковалентные связи. Пример: алмаз, графит, бор, кремний, SiC — карборунд; SiO2 — кварц; некоторые силициды, карбиды, оксиды: Аl2О3; Сr2O3; физические свойства веществ с атомной кристаллической решеткой — твердые, тугоплавкие, нелетучие, в воде нерастворимые. Молекулярные кристаллические решетки — в узлах находятся молекулы, между которыми слабые силы межмолекулярного взаимодействия. Большинство веществ с такой решеткой — газыO2; N2; СO2; Сl2, жидкости — вода, спирт, кислоты, Вr2; твердые вещества — нафталин, I2, нефть, глюкоза, сахароза. Они обладают летучестью, хрупки в кристаллическом виде, имеют низкуюt ° кипения и t ° плавления. В зависимости от полярности молекул они могут быть растворимы в воде, диссоциировать, проводить электрический ток. III. Обобщения и выводы по узловым вопросам темы Таким образом, мы выяснили причины и механизмы образования ионной и ковалентной связи no МВС, а также отметили зависимость физических свойств веществ от вида химической связи, типа кристаллической решетки. Учащимся можно показать демонстрационный опыт, подтверждающий способность поляризованных молекул ориентироваться в электрическом поле и перемещаться в область высокого напряжения. Мехом натирается эбонитовая палочка, которая приближается к тонкой струе воды, вытекающей из бюретки. Струя притягивается к палочке. Струя бензола или эфира не притянется к наэлектризованной палочке. IV. Закрепление 1. Определить вид химической связи в соединениях. Обосновать ответ: ВаСl2; SO2; С2Н6; F2; КВr; I2. 2. В каком из указанных соединений наиболее полярная связь? Расположить соединения в порядке возрастания полярности: HCl; F2; Н2O; NH3; H2S 3. В чем причина резкого отличия в физических свойствах СО2 и SiO2? 4. Как образуется σ-связь и π-связь? Ответы на вопросы закрепления 1. Ионная связь: КВr; ВаСl2. Элементы, образующие соединения, резко отличаются в ЭО. Ковалентная полярная связь. SO2; C2H6 — элементы, образующие соединения, отличаются в ЭО не резко. Ковалентная неполярная связь. F2; I2 — элементы, образующие соединения, одинаковы по ЭО. 2. Наиболее полярная связь в соединении Н2O. ЭОн = 2,1; Э0O = 3,5, разность в ЭО 3,5 - 2,1 = 1,4. 3. СO2 — ковалентная полярная связь: газ. Твердое вещество — молекулярная кристаллическая решетка, легкоплавкое, летучее; SiO2 — ковалентная полярная связь, твердое вещество, тугоплавкое; атомная кристаллическая решетка. 4. σ-связь возникает при осевом перекрывании орбиталей, прочная, труднополяризуемая. π-связь возникает при боковом перекрывании орбиталей, подвижная, легко поляризуемая, непрочная. IV. Домашнее задание 1) § 6 с. 44-51. № 3 2) составить схемы образования химической связи в соединениях КН, NH3, HF; указать вид химической связи, механизм, образования, тип кристаллической решетки, физические свойства веществ, (домашнее задание выполнить на отдельном листе).
![]()
![]()
![]() другая — акцептор, имеющий свободную орбиталь
другая — акцептор, имеющий свободную орбиталь ![]()
![]() — свободная орбиталь, акцептор (Н+Сl)
— свободная орбиталь, акцептор (Н+Сl)![]() — неподеленная пара электронов, донор (К+Н-)
— неподеленная пара электронов, донор (К+Н-)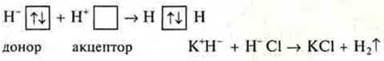
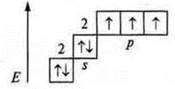
![]() - три связи образованы по обменному механизму: у атома азота есть неподеленная пара электронов 2s2, атом азота — донор, катион водорода
- три связи образованы по обменному механизму: у атома азота есть неподеленная пара электронов 2s2, атом азота — донор, катион водорода ![]() - акцептор
- акцептор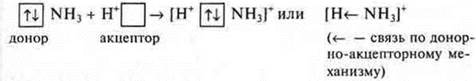
![]()
![]()
![]()
![]()