Поурочные разработки по химии 11 класс
Металлическая и водородная связи. Единая природа химической связи - СТРОЕНИЕ ВЕЩЕСТВА - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: закрепить знание понятий металлической и водородной связи, научить объяснять механизмы их образования, характеризовать физические свойства с данными видами химической связи; дать представление о причинах единства всех типов химической связи.
Оборудование: ПСХЭ Д.И. Менделеева, таблицы видов химической связи; тест на варианты I—II; химические стаканы; вода, этанол, бутанол равные объемы; аспирин, кристаллические решетки, кодотранспоранты. «Принципы комплементарности», HCl сл. диссоц.
Основные понятия: металлическая связь, водородная связь, металлическая кристаллическая решетка, молекулярная кристаллическая решетка.
Ход урока
I. Организационный момент
Учитель ставит цели урока перед учащимися, организует учащихся на проверку изученного материала предыдущего урока. Необходимо также собрать выполненное учащимися домашнее задание.
II. Проведение теста
|
Вариант I |
Вариант II |
|
|
1. Пара элементов, между которыми образуется |
||
|
ионная связь |
ковалентная полярная связь |
|
|
а) С и S |
а) N и Н |
|
|
б) К и О |
б) О и О |
|
|
в) Si и Н |
в) Н и О |
|
|
г) Li и N |
г) Na и F |
|
|
2. Формула соединения |
|
|
|
с ковалентной связью |
с ионной связью |
|
|
a) NaCl; б) НСl; в) ВаО |
a) Ca3N2; б) РН3; в) О2 |
|
|
3. Химическая связь |
|
|
|
наиболее полярна |
наименее полярна |
|
|
а) С—Н |
a) H—S |
|
|
б) C—Cl |
б) Н—O |
|
|
в) С—F |
в) N—Н |
|
|
4. Ковалентная связь |
|
|
|
наиболее прочная |
наименее прочная |
|
|
а) Н2; б) N2; в) F2 |
а) O2; б) Сl2; в) Вr2 |
|
|
5. Верным является утверждение? |
||
|
σ-связь возникает в результате бокового перекрывания орбиталей |
π-связь возникает в результате бокового перекрывания орбиталей |
|
|
6. Даны схемы перекрывания орбиталей: |
||
|
|
|
|
|
Выбрать верные ответы: а) σ-связь; б) π-связь; в) σ- и π-связи |
|
|
|
7. Кристаллическую решетку |
|
|
|
ионну. |
атомную |
|
|
имеют: |
|
|
|
а) алмаз б) фторид калия в) оксид углерода г) сульфид натрия |
а) графит б) хлорид натрия в) йод г) оксид кремния |
|
Ответы на вопросы теста
(Следует ответы записать на скрытой стороне доски и организовать самопроверку.)
|
Вариант I |
Вариант II |
|
1. б), г). |
1. а), в). |
|
2. HCl. |
2. Ca3N2. |
|
3. С—F. |
3. Н—O. |
|
4. N2. |
4. Вr2. |
|
5. Нет. |
5. Да. |
|
6. σ-связь. |
6. π-связь. |
|
7. б), г). |
7. а), г). |
II. Изучение нового материала
План изложения
1. Металлическая связь. Металлическая кристаллическая решетка. Сходства и различия металлической связи с ионной и ковалентной.
2. Водородная связь:
а) механизм возникновения водородной связи;
б) межмолекулярная и внутримолекулярная водородная связь;
в) особенности физических свойств веществ;
г) тип кристаллической решетки соединений с водородной связью;
д) значение водородной связи в живой природе; неживой природе.
3. Единая природа всех видов химической связи. Взаимопереход одного вида связи в другой в зависимости от условий.
4. План характеристики вида химической связи в соединении:
а) вид связи (учитывая ЭО элементов);
б) механизм образования:
в) способы перекрывания орбиталей, σ- или п-связи, их прочность;
г) прочность связи;
д) ток кристаллической решетки;
е) возможные физические свойства вещества, образованные данным соединением.
Все металлы объединяют свойства общего характера, такие как сравнительно высокая t° плавления, способность к отражению света, высокая тепло- и электропроводимость, пластичность. Оказывается, эти особенности обязаны существованию в металлах особого вида химической связи — металлической.
Металлическая связь — связь между положительно заряженными нонами металла в кристалле (атомы-ионы), осуществляемая за счет притяжения электронов, свободно перемещающихся в кристалле.
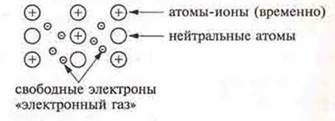
Атомы металлов в соответствии со строением на внешнем энергетическом уровне имеют от 1 до 3 электронов, реже — 4, они слабо связаны с ядром атома, т. к. радиус атомов металлов сравнительно большой. Электроны могут легко отрываться от атомов, в результате чего в кристаллической решетке появляются свободные электроны и атомы-ионы.
В кристаллической решетке существует большая свобода перемещения электронов: одни атомы будут терять электроны, образующиеся ионы могут принимать электроны из «электронного газа».
Свободные электроны общие для большинства ионов металлов кристалла. Этим металлическая связь отличается от ковалентной, где электронная пара общая только для двух атомов. В случае металлической связи электроны равномерно распределены по кристаллу. Этим объясняется пластичность метилов, т.е. возможность смещения ионов и атомов в любом направлении без нарушения связи. Энергия металлической связи в 3—4 раза меньше энергии ковалентной связи.
В газообразном состоянии (в виде пара) атомы металла связаны также непрочными ковалентными связями. Сравним энергию связи в Н2 - 432 кДж/моль; Li2 - 104; Na2 - 71,1; К2 — 49,6.
В кристалле металла связи намного прочнее, чем в состоянии пара: Li — 159; Na —106.
Водородная связь — своеобразная химическая связь. Она возникает вследствие взаимопритяжения положительно заряженного атома водорода одной молекулы (или части ее) и отрицательного заряда атома более электроотрицательного элемента или неподеленной электронной пары другой молекулы (или ее части).
Механизм возникновения водородной связи носит характер частично электростатический, частично донорно-акцепторный.
Молекула воды Н2О полярная ковалентная связь:

Молекула фтороводорода HF — ковалентная полярная связь:
![]()
Молекула аммиака NH3 — ковалентная полярная связь:
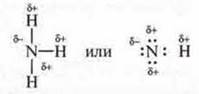
Молекула спирта:

Во всех случаях в молекулах есть общие электронные пары между атомами водорода и электроотрицательными атомами, такими как кислород, фтор, азот, которые смещаются в их сторону. Водород приобретает частично положительный заряд, а атом более электроотрицательного элемента — частично отрицательный заряд. Данные электроотрицательные атомы имеют и неподеленные пары электронов. Молекулы данных соединений взаимопритягиваются.
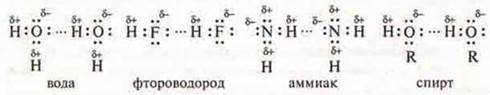
Водородная связь показывается тремя точками (...), она в 15— 20 раз слабее ковалентной связи.
Наличие водородной связи объясняет тот факт, что низкомолекулярные вещества (например, вода, фтороводород, аммиак) при обычных условиях — жидкости или сжижаются.
Водородная связь может возникнуть и между разными молекулами, например воды и спирта.
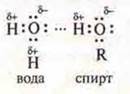
Водородная связь, возникшая между молекулами, называется межмолекулярной. Молекулы воды образуют ассоциаты (Н2O)2; (Н2O)3; (Н2O)4; спирта — ![]() — ассоциатспирта. Этим и объясняется увеличение температуры кипения спиртов по сравнению с углеводородами. Наблюдается хорошее растворение метанола, этанола в воде.
— ассоциатспирта. Этим и объясняется увеличение температуры кипения спиртов по сравнению с углеводородами. Наблюдается хорошее растворение метанола, этанола в воде.
Опыт.
В равных объемах воды хорошо растворяются низкомолекулярные спирты, т. к. возникает межмолекулярная водородная связь. Однако чем больше молекулярная масса спирта, тем растворимость его в воде уменьшается: у таких спиртов намного меньше частичный отрицательный и положительные заряды, водородные связи с молекулами воды образуются слабые.
Вспомним формулу органической кислоты — салициловой:
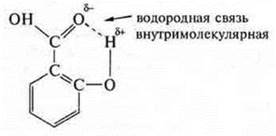
Она возникла за счет наличия в группе —ОН водорода с частичным положительным зарядом и а карбоксильной группе 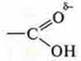 кислорода, имеющего неподеленные ионы электронов, с частичным отрицательным зарядом.
кислорода, имеющего неподеленные ионы электронов, с частичным отрицательным зарядом.
Наибольшее значение внутримолекулярная водородная связь имеет в образовании природной структуры биополимеров: вторичная структура белка, двойная спираль ДНК.
ДНК — биополимер, в котором сконцентрирована наследственная информация живых организмов. Биополимер ДНК состоит из нуклеотидов, располагающихся в полимерных цепях в строгом порядке. При образовании двойной спирали между ними возникают водородные связи и соблюдается принцип комплементарности: А—Т, Г—Ц.
Большие пуриновые основания с малыми пиримидиновыми образуют водородные связи, это энергетически и пространственно выгодно.
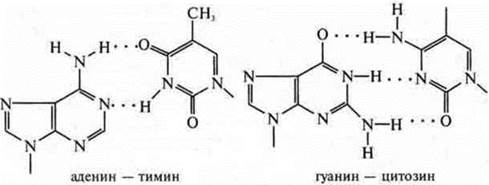
Рекомендуется использовать колотранспоранты, где представлены данные формулы нуклеотидов и как они образуют внутримолекулярные водородные связи.
Все вещества, образующие водородные связи, по физическим свойствам — газы, легко переходящие в жидкости и, наоборот, легко испаряемые, имеют низкую температуру плавления.
Кристаллическая решетка по типу молекулярная. Пример: «сухой лед» — СO2; вода—лед.
Изучив все виды химической связи: ионную, ковалентную, металлическую, водородную — следует отметить, что они имеют единую природу возникновения. Наблюдается электронно-ядерное взаимодействие атомов, сопровождающееся выделением энергии.
Ионная связь — крайний случай ковалентной полярной связи. Степень ионности связи дает судить о том, какой вид связи преобладает.
Пример: LiF — степень ионности 80%, следовательно, в этом соединении 80% — ионная связь, 20% — ковалентная полярная. В ряду галогеноводородов (полярная ковалентная связь) Н—F, Н—Cl, Н—Вr, Н—I полярность связи уменьшается и у Н—At она становится почти неполярной, т. к. уменьшается разность в ЭО.
![]()
Металлическая связь совмещает в себе ковалентную связь — есть обобществленные электроны и ионную связь — наблюдается взаимопритяжение обобществленных электронов и ионов-атомов.
Большинство веществ имеют несколько видов связей.
Пример: основание NaOH. Между атомом кислорода и атомом водорода гидроксогруппы — ковалентная полярная связь, между катионом натрия и анионом гидроксогруппы — ионная связь.
Если рассматривать соли кислородосодержащих кислот, то в кислотном остатке возникает ковалентная полярная связь между атомами кислорода и центральным атомом неметалла, а между катионом металла и анионом кислотного остатка — ионная связь.
Пероксиды: К2O; Na2O2; между атомами кислорода — ковалентная неполярная связь, между металлом и кислородом — ионная связь.
В зависимости от условий возможен переход одного вида связи в другой. При электролитической диссоциации соединений с ковалентной полярной связью наблюдается поляризация молекул сильно полярными молекулами воды и связь становится ионной.
Кодотранспорант:
Схема электролитической диссоциации полярной молекулы хлороводорода на гидратированные ионы
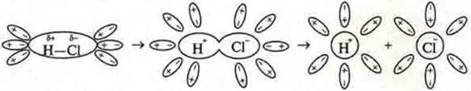
При испарении металлов металлическая связь превращается в ковалентную неполярную.
В органической химии ковалентная неполярная связь галогена Вr2 при его взаимодействии с непредельными углеводородами становится ионной.
Вывод: на основании изучения теории видов химической связи. механизмов их образования, типов кристаллических решеток нам необходимо умело определять в соединениях вид химической связи и характеризовать данное соединение по определенному плану.
1. Виды химической связи (учитывая ЭО элементов).
2. Механизмы их образования. Какие возникают связи σ-, π-, кратность связи.
3. Соответствующий тип кристаллической решетки, физические свойства данного вещества.
IV. Домашнее задание
§ 6. № 3, 4, 6, подготовиться к уроку-семинару и самостоятельной работе.