Поурочные разработки по химии 11 класс
Универсальность теории химического строения А. М. Бутлерова. Современные направления развития теории - СТРОЕНИЕ ВЕЩЕСТВА - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: научить объяснять универсальность теории строения, т. е. применимость ее и для неорганических соединений; дать представление о современных направлениях развития теории строения и ее значении для развития науки и промышленности.
Оборудование: ПСХЭ Д. И. Менделеева, таблицы строения органических соединений.
Ход урока
I. Организационный момент
Сообщение учащимся последовательность работы на уроке. Изучив основные положения теории строения, необходимо подготовить монологические ответы учащихся у доски по данным вопросам:
Ученик 1, 2. Первое положение теории строения, домашнее задание № 5;
Ученик 2. Третье положение теории строения, домашнее задание, сравнение свойств СН3—NH2; С6Н5—NH2;
II. Фронтальная работа
В момент подготовки учащихся у доски все остальные ученики выполняют задание по составлению изомеров и определения типа и вида изомерии формул C3H7NO2; С5Н10.
Ответ: Это кислородосодержащее и азотосодержащее соединение.
Предположим формулу:
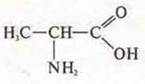 — 2-амино-пропановая кислота.
— 2-амино-пропановая кислота.
Изомер положения: аминогруппы 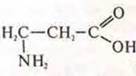 — 3-амино-пропановая кислота
— 3-амино-пропановая кислота
Возможны аминогруппа и нитрогруппа в соединении: 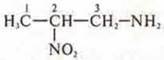 - 3-амино-2-нитропропан
- 3-амино-2-нитропропан
Изомер структурный:
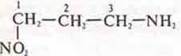 — 3-амино-1-нитропропропан
— 3-амино-1-нитропропропан
б) С5Н10 СnН2n: алкен
![]() - пентен-1
- пентен-1
Изомер по углеродному скелету:
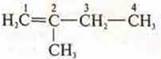 - 2-метилбутен-1
- 2-метилбутен-1
Изомер положения кратной связи:
![]() — пентен-2
— пентен-2
Пространственная, геометрическая:
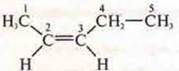 — цис-пентен-2
— цис-пентен-2
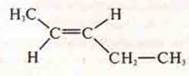 — транс-пентен-1
— транс-пентен-1
Изомер межклассовый:
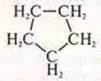 — циклопентан.
— циклопентан.
III. Проверка ответов учащихся у доски
Проверяются ответы учащихся у яоски, гяе теоретический материал подтверждается домашним заданием.
Ученик 1. Первое и второе положение теории строения. Домашнее задание № 5.
Типы изомерии и их виды объясняются домашним заданием.
C3H8O — кислородосодержащее соединение.
Возможно, это спирт, функциональная группа —ОН.
![]() — пропанол-1
— пропанол-1
Структурные изомеры:
положение функциональной группы.
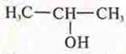 — пропанол-2
— пропанол-2
Межклассовый изомер: простой эфир,
Н3С—О—СН2—СН3 — метил-этиловый эфир.
Ученик 2. Третье положение теории строения.
![]()
В соединениях присутствует аминогруппа, имеющая особенность в строении. У атома азота имеется неподеленная пара электронов, что обеспечивает данной частице большую ЭО.

Основной характер метиламина выражен намного сильнее, чем фенил-амин.
У метиламина электронная плотность азота в аминогруппе 6 усиливается за счет радикала — СН3, что способствует сильному протонированию катиона водорода при взаимодействии вещества с водой НОН и кислотой НСl, у фенил-амина основные свойства ослаблены следующим: неподеленная пара электронов атома азота вступает в сопряжение с п-электронным облаком ароматического кольца, вследствие чего снижается электронная плотность, ослабевает способность вещества протонировать катион водорода при взаимодействии с водой и кислотой. Подводятся итоги проверки домашнего задания, выставляются поурочные баллы.
Универсальность теории строения — это возможность использования ее положений для объяснения структуры неорганических веществ, существовании у неорганических веществ изомеров.
Например:
а) цианат аммония NH4OCN — неорганическое вещество;
мочевина — CO(NH2)2 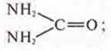
б) тиомочевина 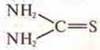 и роданид аммония H4N—S—C≡N.
и роданид аммония H4N—S—C≡N.
Явление взаимного влияния атомов в соединениях можно рассмотреть на примере водородных соединений неметаллов и изменений их свойств в периодах и группах, главных подгруппах. К концу периода усиливается кислотный характер водородных соединений. К концу группы главной подгруппы ослабевает основной характер, усиливается кислотный. Такие изменения объясняются различной способностью водородных соединений неметаллов к отщеплению или присоединению катионов водорода в растворах, так как в соединениях атом неметалла оказывает неодинаковое влияние на атомы водорода.
Пример 1. ![]() (соединения образованы элементами одной группы главной подгруппы); у NH3 (аммиак) — основные свойства выражены сильнее, чем у РН3 (фосфин), т. к. радиус атома фосфора больше радиуса атома азота, он слабее притягивает атомы водорода; заряд ядра атома фосфора больше заряда ядра атома азота и он сильнее отталкивает атом водорода, что характеризует кислотный характер:
(соединения образованы элементами одной группы главной подгруппы); у NH3 (аммиак) — основные свойства выражены сильнее, чем у РН3 (фосфин), т. к. радиус атома фосфора больше радиуса атома азота, он слабее притягивает атомы водорода; заряд ядра атома фосфора больше заряда ядра атома азота и он сильнее отталкивает атом водорода, что характеризует кислотный характер:
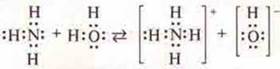
Пример 2. ![]() (соединения образованы элементами одного периода). Кислотные свойства HF выражены сильнее, чем Н2О, т. к. радиус атома фтора меньше, а заряд ядра больше, чем у кислорода. что вызывает увеличение силы отталкивания атома водорода
(соединения образованы элементами одного периода). Кислотные свойства HF выражены сильнее, чем Н2О, т. к. радиус атома фтора меньше, а заряд ядра больше, чем у кислорода. что вызывает увеличение силы отталкивания атома водорода
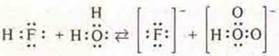
Если рассматривать гидроксиды, образованные элементами одного периода, то наблюдается изменение у этих соединений кислотно-основных свойств к концу периода.
Основные свойства гидроксидов убывают, а кислотные усиливаются, т. к. увеличивается степень окисления центрального атома, растет энергия связи его с атомом кислорода и увеличивается сила отталкивания им атома водорода.
Пример 1. ![]() — гидроксид натрия. Более прочная связь между атомом кислорода и водорода, чем связь атома кислорода и атома натрия. Радиус атома водорода меньше, чем радиус атома натрия.
— гидроксид натрия. Более прочная связь между атомом кислорода и водорода, чем связь атома кислорода и атома натрия. Радиус атома водорода меньше, чем радиус атома натрия.
Диссоциация: ![]()
Пример 2. ![]() — хлорная кислота, атом хлора с наибольшей С.О. и наименьшим радиусом прочнее связан с атомами кислорода и сильнее отталкивает от себя атом водорода.
— хлорная кислота, атом хлора с наибольшей С.О. и наименьшим радиусом прочнее связан с атомами кислорода и сильнее отталкивает от себя атом водорода.
Диссоциация: ![]()
Каковы же современные направления развития теории строения соединений? Следует отметить следующее.
1. Химические формулы органических и неорганических соединений можно записывать не только структурными формулами, но и полуструктурными, сокращенными и электронными.
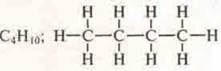 — структурная формула;
— структурная формула;
Н3С—СН2—СН2—СН3 — полуструктурная формула;
Н3С—(СН2)2— СН3— сокращенная формула;
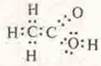 — электронная формула.
— электронная формула.
2. Электронные формулы дают возможность объяснения двух эффектов в органических соединениях — индуктивного и мезомерного.
а) индуктивный эффект — смещение электронной плотности по системе σ-связей, учитывая различия в ЭО.
Пример:
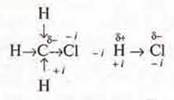
-i — отрицательный индуктивный эффект,
+i — положительный индуктивный эффект,
б) мезомерный эффект М — смещение электронной плотности по π-связи или смещение неподеленных электронных пар при наличии чередующих простых и кратных связей.
Мезомерный эффект сильнее индукционного.
Пример:
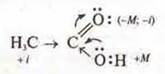
Электронные эффекты влияют на реакционную способность соединения, а также на направление протекания процесса.
Правило Марковникова: присоединение галогеноводорода по кратной связи.
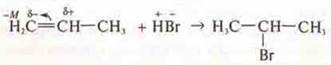
Водород присоединяется к наиболее гидрированному атому углерода при кратной связи.
Возможно присоединение вопреки правилу Марковникова вследствие действия эффектов М и i.
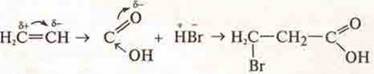
3. Идет развитие учения о пространственной изомерии — стереохимии.
Эту идею в 1874 г. высказали французский химик Ж. А. М Бель и голландский химик Л. X. Вант-Гофф. Их предположения подтверждены квантовой химией. На свойство веществ влияние оказывает пространственное строение их молекул: цис- и транс-изомеры. Процесс применения пространственного изомера требует большого расхода энергии. При обычных условиях невозможен. Примеров пространственного изменения много при синтезе ВМС (высокомолекулярных соединений). Идет синтез стереорегулярных каучуков, состоящих только из цис-звеньев, что обеспечивает высокую эластичность. Поэтому следует дополнить второе положение теории строения соединений: свойства веществ зависят не только от их качественного и количественного состава, но и от их химического, электронно-пространственного строения.
4. Благодаря теории строения соединений органическая химия превратилась из науки описательной в науку созидательную.
В настоящее время стало возможным синтезировать вещества с заранее заданными свойствами, прогнозировать изомерию веществ, а также описывать направления и протекание реакций синтеза.
Благодаря теории строения создано много веществ, заменяющих природные полимеры, красители, белки, необходимые в технике, быту, медицине, сельском хозяйстве.
Неоспорима значимость теории строения соединений А. М. Бутлерова для органической химии, также как и Периодического закона и Периодической системы химических элементов Д. И. Менделеева для неорганической химии. В обеих теориях много общего в путях их становления, направления развития и научных знаний.
Обобщение и выводы по узловым вопросам.
IV. Домашнее задание
§ 9, вопросы № 1, 2, 3 устно.
Сравнить: 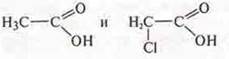
Прогнозируемое вещество: 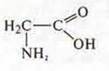
V. Закрепление
По структурной формуле проанализировать смещение электронной плотности, реакционные центры, предположить химическую активность:
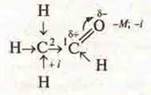
С.О. атома C1 +1 промежуточные; С.О. атома С2 -3 могут окисляться.
1) между С и О двойная связь: σ- и π- возможна реакция присоединения;
2) в связи с поляризацией атома Н в СН3 возможна реакция замещения;
3) реакция окисления, т. к. самый уязвимый атом Н в альдегидной группе.