Поурочные разработки по химии 11 класс
Теория химического строения органических соединений А. М. Бутлерова. Современные направления развития теории - СТРОЕНИЕ ВЕЩЕСТВА - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: сравнить основы общности двух ведущих теорий химии: теории периодичности Д.И. Менделеева и теории строения А. М. Бутлерова: раскрыть представленные теории строения соединений, предложенные предшественниками А.М. Бутлерова; теория радикалов, теория типов; все предпосылки создания теории строения химических соединений; закрепить знание основных положений теории химического строения; научить применять их, описывая строение соединений не только органических, но и неорганических.
Основные понятия: теория радикалов, теория типов, цепи углеродных атомов — открытые, разветвленные, замкнутые, связи — одинарные, двойные, тройные; изомерия: структурная, пространственная, межклассовая.
Оборудование: таблицы строения органических соединений, шаростержневые модели металла, этана, этина, кристаллические решетки (модели), кодотранспоранты (таблицы типов, таблицы радикалов, задания), фенол, р—р Br2, р—р I2, NaOH.
Ход урока
I. Организационный момент
Учитель анализирует результаты самостоятельной работы, акцентирует внимание учащихся на типичных ошибках. Домашнее задание: тип гибридизации, геометрия частиц проверяется в устной форме.
II. Изучение нового материала
План изложения материала
1. Сравнение двух ведущих теорий химии: Периодического закона Д. И. Менделеева и теории химического строения А. М. Бутлерова.
2. Основные общности двух ведущих теорий химии.
3. Первое положение теории строения.
4. Второе положение теории строения.
Изомерия, виды изомерии.
5. Третье положение теории строения — взаимное влияние атомов в молекулах веществ.
Рассмотреть на примере фенола.
III. Вступительная беседа
Теории периодичности Д. И. Менделеева и теории химического строения А. М. Бутлерова были созданы великими русскими учеными и составляют вклад отечественной химии в мировую химическую науку. Они прошли испытания временем и блестяще его выдержали, развиваясь и обогащаясь современными открытиями химии. На кодотранспоранте записаны высказывания ученых, их считают пророческими.
«Периодическому закону будущее не грозит разрушением, а лишь развитие и надстройки обещаются» (Д. И. Менделеев).
«Само собой разумеется, что, когда мы будем знать ближе натуру химической энергии, самый род атомного движения — когда законы механики получат и здесь приложение, тогда учение о химическом строении падет, как падали прежние химические теории. Но подобно большинству этих теорий, она падет не для того, чтобы исчезнуть, а для того чтобы войти в измененном виде в круг новых и более широких воззрений» (А. М. Бутлеров).
Учитель предлагает учащимся сравнить основы общности двух ведущих теорий химии.
Сравнение двух ведущих теорий химии
|
Признак |
Периодический закон. Д. И. Менделеев |
Теория строения. А. М. Бутлеров |
|
Время открытия |
1869 г. |
1861 г. |
|
Предпосылки |
Было известно 63 элемента и описаны свойства их многочисленных соединений |
Известно много органических соединений — сотни тысяч состоящих из атомов; С, Н, О, реже N, Р и S |
|
Работы предшественников |
Классификация Й. Берцелиуса (металлы и неметаллы): И. В. Дебсрейнер (триады); Д. А. Р. Ньюлендс (октавы); Л. Мейер |
Й. Берцелиус. Ж. Дюма (теория радикала); Ж. Дюма, Ш. Жерар, О. Лоран (теория типов). Й. Берцелиус ввел термин «изомерия»; Ф. Велер, Н. Н. Зимин, М. Бертло, сам А. М. Бутлеров (синтезы органических веществ, крах витамизма): Ф. А. Кекуле (строение бензола) |
|
|
Периодический закон. Д. И. Менделеев |
Теория строения. А. М. Бутлеров |
|
Съезд химиков в Карлсруэ, 1860 г. |
Д. И. Менделеев присутствовал в роли наблюдателя |
А. М. Бутлеров не участвовал (но активно изучал материалы съезда). Принимал участие в съезде врачей и естествоиспытателей в г. Шпейере в 1861 г., где выступил с докладом «О строении органических тел» |
|
Личностные качества |
Обоих авторов отличали от других химиков: энциклопедичность химических знаний, умение анализировать и обобщать фактическое, научное прогнозирование, русский менталитет и русский патриотизм. Д. И. Менделеев об А. М. Бутлерове: «А. М. Бутлеров— один из величайших русских ученых, он русский и по ученому образованию и по оригинальности трудов» |
|
|
Роль практики в становлении теории |
Д. И. Менделеев предсказывает, описывает и указывает пути открытия еще неизвестных науке галлия, скандия и германия |
А. М. Бутлеров предсказывает и объясняет изомерию органических соединений, сам осуществляет многие синтезы |
|
Основные направления развития теории (по спирали) |
«Свойства химических элементов и образуемых ими веществ находятся в периодической зависимости от их относительных атомных масс» «...От зарядов их атомных ядер» «От периодичности в изменении внешних электронных слоев атомов» |
«Свойства веществ зависят от порядка соединения атомов в молекуле - от их химического строения» «От их пространственного строения» «От их электронного строения» |
Примечание. По книге: О. С. Габриелян. Химия: 11 класс: Настольная книга учителя. Ч. I., Дрофа. 2003. С. 110-111.
Учащиеся, работая с учебником и текстом конспектов уроков химии в 10 классе, формулируют и раскрывают первое положение теории химического строения.
Атомы в молекулах органических и неорганических веществ соединяются в строго определенной последовательности, согласно их валентности. Углерод во всех органических соединениях и большинстве неорганических всегда имеет валентность IV; кислород — II, азот — III, водород — I.
Четырехвалентность углерода учащиеся объясняют, рассматривая строение атома углерода в основном и в возбужденном состоянии на основе знаний о гибридизации атомных орбиталей.
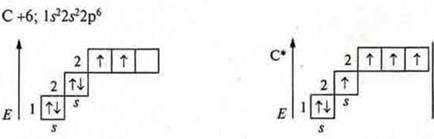
У атома углерода в возбужденном состоянии четыре неспаренных электрона, на орбитали s- — один и р- — три.
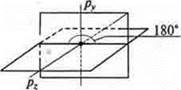
При гибридизации sp3 образуются четыре гибридные орбитали, угол 109°28'. При sp2-гибридизации образуются три гибридные орбитали, угол 120° и остается одна негибридная р-орбиталь, расположенная в пространстве в плоскости, перпендикулярной плоскости гибридных орбиталей.
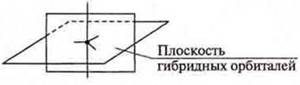
При sp-гибридизации образуются две гибридные орбитали, угол 180° и остаются две негибридные p-орбитали, расположенные в пространстве в плоскостях взаимноперпендикулярных.
Атомы углерода в органических соединениях образуют цепи углеродных атомов, валентность обозначается черточкой:
а) открытые:
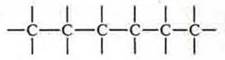
б) разветвленные:
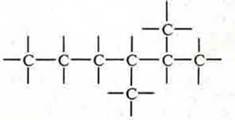
в) замкнутые:
Структурная схема:
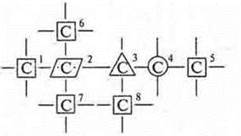
Необходимо вспомнить понятия: первичный, вторичный, третичный, четвертичный атом углерода. Все зависит от того, со сколькими атомами углерода соединен данный атом. В данном соединении 8 атомов углерода.
Углероды № 1, 5, 6, 7, 8 — первичные, ![]()
№ 4 — вторичный, ![]()
№ 3 — третичный, ![]()
№ 2 — четвертичный, ![]()
Можно условно ввести обозначения таких атомов.
В зависимости от гибридизации АО между атомами углерода могут образоваться:
а) одинарная связь при sp3-гибридизации, длина связи 0,154 нм σ-связи:
![]()
б) двойная связь при sp2-гибридизации, одна σ-связь, другая π-связь, длина двойной связи 0,134 нм:
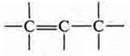
в) тройная связь при sp-гибридизации, одна σ-связь и две π-связи, длина тройной связи 0,120 нм. самая короткая связь:
![]()
На основании первого положения у соединения мы можем составить структурную формулу с учетом валентности, образующих его атомов и если атомы углерода, то с учетом его гибридизации.
Задание: Составить структурные формулы соединений
органических:
алкана С4Н10: 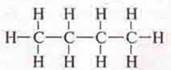
полуструктурная формула: Н3С—СН2—СН2—СН3
алкена C4H8: 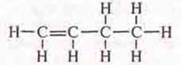
полуструктурная формула Н2С=СН—СН2—СН3
алкина С4Н6: 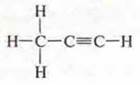
полуструктурная формула Н3С—С≡СН
и неорганических:
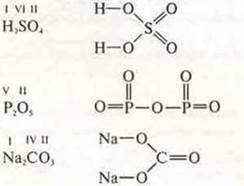
Атомы углерода, имея разную гибридизацию, образуют три простых аллотропных видоизменения с атомными кристаллическими решетками:
алмаз — sp3-гибридизация;
графит - sp2-гибридизация: поликуммулен, фуллерены;
карбин — sp-гибридизация.
Задание: Состав органического вещества С2Н6O. Предложите структурные формулы, полуструктурные данному соединению.
Первая формула: Н3С—О—СН3 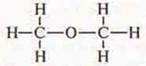
Все атомы водорода. Равноценный атом кислорода — самый ЭО, одинаково влияет на атомы углерода и водорода. Это эфир: газ, низкая t° кипения — 23,6°, растворимый в воде (в 1 объеме воды при 18° растворяется 37 объемов эфира), не взаимодействует с металлическим натрием.
Вторая формула: 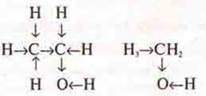
В этом соединении есть неравноценный атом водорода, он непосредственно соединен с ЭО атомом кислорода, который более сильно оказывает влияние на него, чем на оставшиеся атомы водорода, соединенные с атомом углерода.
Связи-стрелки показывают смещение электронной плотности в соединении к ЭО атому кислорода. Это спирт, хорошо растворим в Н2O и взаимодействует с Na.
Вывод: Эфир и спирт — одного качественного и количественного состава, но они обладают разными свойствами. Чем это объяснить?
Оказывается, свойства вещества зависят не только от их качественного и количественного состава, но и от их химического строения. На конкретном примере мы в этом убедились. Такие соединения были названы изомерами. От греческого isos — равный и meros — доля, часть. Это явление было открыто еще в 1823 г. К. Либихом и Ф. Велером на примере солей двух неорганических кислот: циановой Н—О—C≡N и гремучей Н—О—N≡C. В 1830 г. Ж. Дюма распространил представление об изометрии на органическом соединении. Термин «изомер» предложил Й. Берцелиус. Однако этому открытию не придали особого значения, т. к. в органической химии царил полный хаос. А. М. Бутлеров дал научное объяснение явлению изомерии в рамках теории строения, в то время как ни теория типов, ни теория радикалов не раскрывали сути этого явления. Бутлеров причину изомерии видел в том. что атомы в молекулах изомеров связаны в различном порядке. На основании теории строения А. М. Бутлерова можно предсказать число возможных изомеров и их структуру. Экспериментально это было доказано А. М. Бутлеровым и его последователями.
Сформулируем еще раз второе положение теории строения.
Свойства веществ зависят не только от того, какие атомы каких элементов и сколько их входят в состав молекулы, но и от того, как они соединены между собой.
В дальнейшей беседе с учащимися рассматриваются типы изомерии: структурная изомерия и пространственная.
Видами структурной изомерии являются: изомерия углеродного скелета; изомерия положения кратной связи функциональной группы, заместителей; межклассовая изомерия.
Видами пространственной изомерии являются геометрическая цис- и транс-изомерия оптическая.
III. Выполнение заданий (на кодотранспоранте)
Задание: Определить виды изомерии, сравнивая соединения, дать названия.
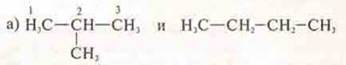
Ответ: 2-метилпропан; н-бутан;
структурная, углеродный скелет;
![]()
Ответ: бутен-2; бутен-1;
структурная, положение кратной связи;
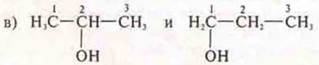
Ответ: пропанол-2; пропанол-1;
структурная, положение функциональной гр.;
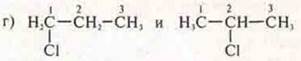
Ответ: 1-хлорпропан; 2-хлорпропан;
изомерия структурная, положение заместителя;
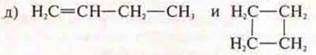
Ответ: бутен-1; циклобутан;
структурная изомерия, межклассовая;
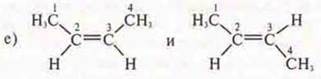
Ответ: цис-бутен-2; транс-бутен-2;
пространственная, геометрическая;
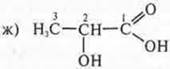
Ответ: молочная кислота, 2-гидроксипропановая килота.
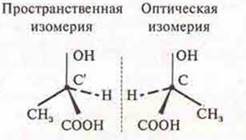
Оптические изомеры молочной кислоты
Рассмотрим, вспомним третье положение теории строения о взаимном влиянии атомов в молекулах веществ.
Свойства вещества зависят не только от строения, порядка соединения атомов в молекуле, но и от их взаимного влияния друг на друга.
Наличие функциональных групп в соединениях, заместителей сказывается на особенностях свойств веществ. Рассмотрим взаимное влияние атомов и групп атомов в молекуле фенола С6Н5—ОН. Для объяснения данного явления вспомним такие опыты.
Опыт 1. Взаимодействие фенола с Вr2. В пробирку к фенолу приливаем бромную воду (если бромной воды нет, хорошо проходит опыт с раствором I2). Наблюдается осадок желтоватый с бромной водой, а с раствором I2 желтый цвет исчезает. Фенол взаимодействует и с Вr2 и с I2.
Опыт 2. К розоватой эмульсии фенола приливаем гидроксид натрия, встряхиваем. Раствор становится прозрачным. Фенол взаимодействует с гидроксидом натрия, проявляя кислотные свойства. Почему? Рассмотрим взаимное влияние атомов в молекуле фенола.
а) влияние группы —ОН на ароматическое кольцо.
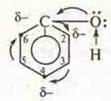
Неподеленная пара электронов кислорода группы —ОН вступает в сопряжение с р-электронным облаком ароматического кольца, вследствие чего в кольце происходит перераспределение электронной плотности, наибольшую электронную плотность приобретают атомы углерода под № 2, 4, 6. Это дает возможность легкого замещения атомов водорода на атомы галогенов (опыт 1);
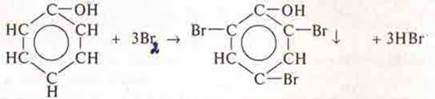
Реакция замещения
б) влияние ароматического кольца на группу —ОН.
Вследствие того, что пара электронов атома кислорода вступает в сопряжение с π-электронным облаком ароматического кольца, атом кислорода теряет электронную плотность, чтобы ее восполнить происходит смещение общей электронной пары с атомом водорода в свою сторону. Это обеспечивает его подвижность, фенол становится способным отдавать протон, проявлять кислотные свойства (опыт 2). Кислота намного слабее угольной кислоты.
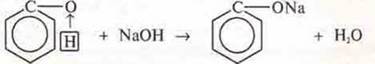
Угольная кислота способна вытеснить фенол и фенолята натрия.
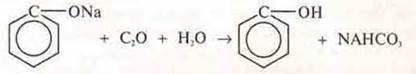
IV. Обобщение и выводы
Таким образом, на данном уроке мы обобщили, закрепили на более высоком научно-теоретическом уровне знания теории строения соединений А. М. Бутлерова. В чем ее универсальность мы рассмотрим на следующем уроке.
Основной вывод, который следует сделать, следующий.
По строению вещества можно предположить свойства данного вещества:
а) наличие только σ-связей — реакции замещения;
б) наличие π-связей — реакции присоединения;
в) наличие элемента с максимальной С.О. — окислительные свойства;
г) наличие элемента с минимальной С.О. — восстановительные свойства;
д) наличие элемента с промежуточной С.О. и окислительные и восстановительные свойства;
е) наличие элемента с высокой электронной плотностью, имеющего неподеленные электронные пары:
:Эδ- — придают основные свойства, а также кислотные свойства— способность отщеплять Н+ (наличие сильной полярности)
Сδ—Н
Например, в ряду С2Н6; С2Н4; С2Н2 усиливается кислотность, т.к. изменяется гибридизация атома углерода, уменьшается длина связи, ослабевает связь водорода с атомом углерода, возрастает способность замещаться.
IV. Домашнее задание
§ 9 (до с. 80); № 5, 6; сравнить основные свойства СН3—NH2 и C6H5—NH2.