Поурочные разработки по химии 11 класс
Составление ОВР методом электронного баланса - ХИМИЧЕСКИЕ РЕАКЦИИ - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: дать представление о методе электронного баланса в составлении ОВР; совершенствовать умение отражать сущность ОВР методом электронного баланса, закрепляя понятия процессов окисления, восстановления: закрепить понятия «окислитель», «восстановитель».
Основные понятия: алгоритм, схема электронного баланса, процессы окисления, восстановления, окислитель, восстановитель.
Ход урока
I. Проверка знаний учащихся
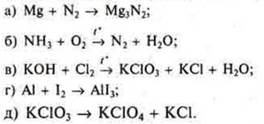
1) Записать уравнения ОВР из текста § 11, указать тип ОВР, тип классификации, окислитель, восстановитель.
![]()
реакция соединения ![]() — восстановитель, т.к.
— восстановитель, т.к.
![]() повышает С.О. до
повышает С.О. до ![]() в SO3;
в SO3;
![]() — окислитель, т. к.
— окислитель, т. к. ![]() понижает С.О. до
понижает С.О. до ![]() в
в ![]()
ОВР межмолекулярная;
![]()
реакция разложения:
КМnO4 — окислитель, т. к. ![]() понижает С.О. в соединениях
понижает С.О. в соединениях ![]() и
и ![]()
КМnO4 — восстановитель, т. к. ![]() в
в ![]() повышает С.О. в соединении
повышает С.О. в соединении ![]() .
.
ОВР — внутримолекулярная, а для марганца и реакция диспропорционирования;
![]()
реакция замещения:
![]() повышает С.О. до
повышает С.О. до ![]() — восстановитель;
— восстановитель;
![]() в соединении Сr2O3 понижает С.О. до
в соединении Сr2O3 понижает С.О. до ![]() — окислитель;
— окислитель;
ОВР — межмолекулярная.
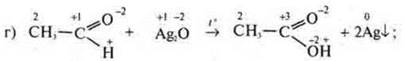
реакция неполного окисления органического соединения;
ОВР межмолкекулярная, т. к. ![]() в альдегиде повышает С.О. до
в альдегиде повышает С.О. до ![]() в кислоте, альдегид — восстановитель.
в кислоте, альдегид — восстановитель.
![]() понижает С.О. до
понижает С.О. до ![]() Ag2O — окислитель.
Ag2O — окислитель.
ОВР являются некоторые реакции соединения, разложения, реакции замещения.
Окислитель — всегда С.О. понижает.
Восстановитель — всегда С.О. повышает.
Вопрос: В качестве окислителя или восстановителя выступают частицы в схемах? Какие идут процессы?
![]() — повышение С.О. А0 — восстановитель (в-ль), процесс окисления — отдача электронов;
— повышение С.О. А0 — восстановитель (в-ль), процесс окисления — отдача электронов;
![]() — повышение С.О. В-3 — восстановитель (в-ль), процесс окисления — отдача электронов;
— повышение С.О. В-3 — восстановитель (в-ль), процесс окисления — отдача электронов;
![]() — понижение С.О. D+6 — окислитель (о-ль), процесс восстановления — присоединение электронов.
— понижение С.О. D+6 — окислитель (о-ль), процесс восстановления — присоединение электронов.
![]() — понижение С.О. С0 - окислитель (о-ль), процесс восстановления — присоединение электронов.
— понижение С.О. С0 - окислитель (о-ль), процесс восстановления — присоединение электронов.
Итак, процессы:
Восстановление (в-е) — присоединение электронов атомом, частицей.
Окисление (о-е) — отдача электронов атомом, частицей.
Далее идет переход к изучению нового материала.
II. Изучение нового материала:
План изложения:
1. Методы или приемы составления ОВР.
2. Метод электронного баланса. Алгоритм.
3. Некоторые случаи, которые следует помнить при составлении ОВР методом электронного баланса.
Известно несколько приемов составления ОВР. Нам необходимо основательно разобраться и уметь применять в составлении ОВР метод электронного баланса. Однако, в случае очень сложных ОВР, когда участвуют в качестве окислителя и восстановителя не просто атомы или ионы, а частицы с определенным зарядом, используют электронно-ионный метод составления ОВР. Учащимся, которые при поступлении в вуз будут сдавать экзамен по химии, этот метод следует знать. При составлении ОВР таким методом знание среды ОВР (кислая, щелочная, нейтральная) обязательно.
Для быстроты составления ОВР, экономии времени, особенно при выполнении тестовых заданий, где требуется только короткий ответ, существует подстрочный прием составления ОВР.
Алгоритм составления ОВР методом электронного баланса
1. Составить схему реакции и определить С.О. элементов в исходных и конечных продуктах реакции:
![]()
2. Определить:
а) элемент, который повысил С.О.;
б) элемент, который понизил С.О.
3. Составляем схему электронного баланса, рассуждая так.
![]()
Элемент А С.О. повысил с 0 до +n, выступил как восстановитель, а сам окислился, т. к. идет процесс отдачи электронов. Окисление.
б) Элемент В0 С.О. понизил с 0 до -m, выступил как окислитель, а сам восстановился, т. к. идет процесс присоединения электронов — восстановление:
![]()
Обращаем внимание на сокращение некоторых понятий:
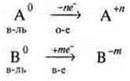
Это и есть начало схемы электронного баланса.
в) Необходимо сбалансировать число электронов между окислителем и восстановителем. Найти наименьший общий множитель и определить коэффициенты перед окислителем и восстановителем, перед конечными продуктами реакции.
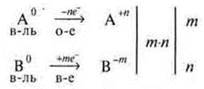 m·n — наименьший общий множитель
m·n — наименьший общий множитель
г) В уравнение реакции коэффициенты записываем, как правило, в начале, перед продуктами реакции в правой части уравнения (где есть элементы с изменением С.О.), а затем сравниваем количество частиц атомов с левой частью уравнения и ставим коэффициенты перед веществом исходных продуктов реакции.
Следует помнить! В ОВР предпоследним уравнивается водород, а последним сравнивается количество кислорода в левой и правой части уравнения.
В случае несоответствия атомов кислорода в левой и правой части уравнения следует проверить правильность:
а) определения С.О. и элементов;
б) процессы окисления и восстановления в схеме электронного баланса (количество принятых и отданных (электронов);
в) определения коэффициентов:
![]() — уравнение ОВР с коэффициентами.
— уравнение ОВР с коэффициентами.
Рассмотрим на конкретном примере:
![]()
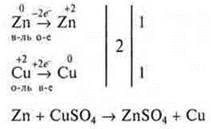
Коэффициент 1 — не ставится.
Сравниваем атомы О: в левой и правой части по четыре атома.
Особые случаи в составлении ОВР
1) Если в реакции участвуют как реагенты, так и продукт реакции в молекулярном состоянии (O2;N2;Cl2), то при составлении схемы электронного баланса это учитывается.
Пример:
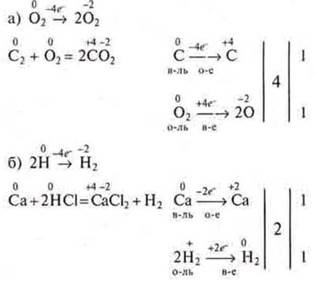
2) Иногда найденные коэффициенты ставим перед продуктами исходными в левой части уравнения.
В уравнениях реакций коммутации коэффициенты проставляются вначале в левую часть уравнения.
Пример:
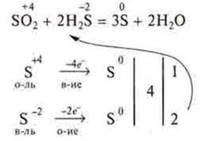
3) Для веществ, в которых одновременно окисляются и восстанавливаются атомы двух, трех и т. д. элементов, расчет ведут на одну молекулу частицы. Для внутримолекулярных ОВР.
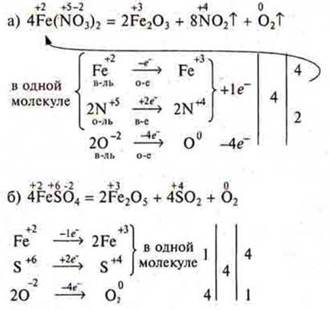
4) Для веществ, в которых одновременно окисляются (или восстанавливаются) атомы двух элементов, расчет ведут на одну молекулу вещества.

III. Закрепление
Рассмотрим на конкретном примере другие случаи.
Пример 1.
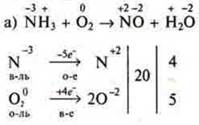
![]()
В этом уравнении в правой части атомы кислорода находятся в двух соединениях, поэтому коэффициент 5 поставим перед кислородом в левой части уравнения и 4 перед NH3 — в левой части, а далее уравниваем по схеме.
Пример 2.
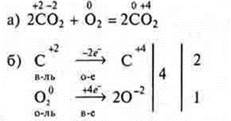
Пример 3.
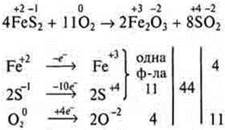
Пример 4.
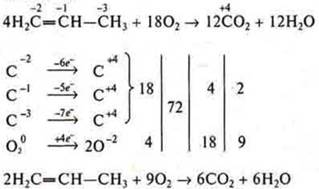
IV. Домашнее задание
1. Конспект.
2. Составить ОВР методом электронного баланса: