Поурочные разработки по химии 11 класс
Окислительно-восстановительные реакции. Классификация ОВР - ХИМИЧЕСКИЕ РЕАКЦИИ - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: систематизировать знания учащихся о классификации химических реакций в свете электронной теории; научить объяснять основные понятия ОВР; дать классификацию ОВР.
Основные понятия: окислительно-восстановительные реакции, окислитель, восстановитель, процессы окисления и восстановления, реакции межмолекулярные, внутримолекулярные, диспропорционирования. Оборудование: ПСХЭ Д. И. Менделеева.
Ход урока
I. Организационный момент
Проверка знаний учащихся. Обсуждение выполнения домашнего задания.
№ 1 § 11
![]()
1. Реакция с изменением состава вещества — реакция соединения.
2. Это ОВР, т. к. элементы S, О изменяют С.О.
3. По тепловому эффекту — экзотермическая реакция.
4. По фазе — гетерогенная, вещества в разных агрегатных состояниях.
5. По обратимости — необратимая.
6. Реакция некаталитическая.
№ 3, § 1
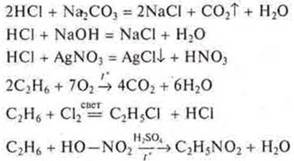
№ 6 § 11
![]()
1. Реакция с изменением состава веществ — реакция замещения по радикальному механизму.
2. Реакция окислительно-восстановительная, т. к. элемент изменяет СО.
3. По тепловому эффекту — экзотермическая, +Q.
4. По фазе — гомогенная, вещества в одинаковом агрегатном состоянии.
5. По обратимости — необратимая.
6. Реакция протекает на свету. Свет — катализатор.
II. Самостоятельная работа
Дать характеристику химических реакций по признакам классификации.
Вариант I
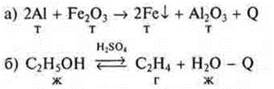
Вариант II
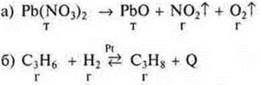
III. Изучение нового материала План изложения
1. Процессы: а) окисления; б) восстановления.
Изменение С.О. элементов при окислении и восстановлении.
2. Окислитель и восстановитель. Умение определять функции вещества, частицы по С.О. элемента.
3. Важнейшие окислители и восстановители.
4. Определение реакции ОВР.
5. Классификация ОВР:
а) межмолекулярная;
б) внутримолекулярная;
в) диспропорционирование.
6. Условия протекания ОВР.
7. Значение ОВР.
При образовании определенных видов химической связи происходят процессы отдачи электронов атомом или их присоединение; возможно образование общих электронных пар или заряженных частиц — катионов и анионов.
Процесс принятия электронов атомом, частицей называется восстановлением. Наблюдается понижение степени окисления атома, частицы:
![]()
Процесс отдачи электронов атомом, частицей называется окислением, наблюдается повышение степени окисления атома, частицы:
![]()
Таким образом:
при восстановлении — С.О. понижается;
при окислении — С.О. повышается.
Восстановитель — частица, атом, молекула, отдающие электроны (это доноры электронов donar — дарить). Восстановитель всегда повышает С.О.
Окислитель — частица, атом, молекула, принимающие электроны (это акцептор — получатель). Окислитель всегда понижает С.О. Нам необходимо сформулировать правила определения функции соединения в ОВР.
а) если в соединении элемент находится в минимальной С.О. — соединение (частица) выступает в роли восстановителя.
Пример: ![]() — минимальная, С.О. ниже быть не может, возможно только повышение С.О. — отдача электронов, окисляться и быть восстановителем.
— минимальная, С.О. ниже быть не может, возможно только повышение С.О. — отдача электронов, окисляться и быть восстановителем.
б) если в соединении элемент находится в максимальной С.О. — соединение (частица) выступает в роли окислителя.
Пример: ![]() — максимальная С.О., выше быть не может, возможно только ее понижение, т.е. принятие электронов, восстанавливаться и быть окислителем;
— максимальная С.О., выше быть не может, возможно только ее понижение, т.е. принятие электронов, восстанавливаться и быть окислителем;
в) если в соединении (частице) элемент находится в промежуточной С.О. — соединение (частица) выступить может и окислителем — понизить С.О, и восстановителем — повысить С.О. Все зависит от условий протекания реакции, а также от тех соединений, с которыми реагирует.
Пример: ![]() — промежуточная, она может и понизиться до S-2 и повыситься до S+6.
— промежуточная, она может и понизиться до S-2 и повыситься до S+6.
IV. Выполнение задания
В качестве закрепления этой части теории выполняется задание.
Даны процессы:

указать: а) процессы: окисления; восстановления;
б) количество отданных или принятых е-.
в) окислитель, восстановитель.
Ответ:
Процессы окисления — отдача электронов — повышение С.О.:
в) ![]() частица N-3 — восстановитель;
частица N-3 — восстановитель;
г) ![]() частица Fe+2 — восстановитель;
частица Fe+2 — восстановитель;
е) ![]() атом Аl0 — восстановитель.
атом Аl0 — восстановитель.
Процессы восстановления — принятие электронов, понижение СО.:
а) ![]() — окислитель:
— окислитель:
б) ![]() — окислитель;
— окислитель;
д) ![]() — окислитель.
— окислитель.
Далее учащиеся знакомятся с некоторыми важнейшими окислителями и восстановителями.
Окислители: ![]() и др.;
и др.;
В данных соединениях элемент в максимальной С.О. Некоторые простые вещества выступают чаще как окислители: O2; O2; F2; Сl2.
Восстановители: ![]() В данных соединениях элемент находится в минимальной С.О. Из простых веществ хорошие восстановители Н2; СО; С, металлы.
В данных соединениях элемент находится в минимальной С.О. Из простых веществ хорошие восстановители Н2; СО; С, металлы.
Все химические реакции, протекающие с изменением С.О. элементов называются окислительно-восстановительными.
Окислительно-восстановительные реакции сопровождаются протеканием процессов окисления — отдачи электронов (частицей, атомом, молекулой и процессов восстановления — присоединения электронов (частицей, атомом, молекулой).
ОВР классифицируются по признаку нахождения окислителя и восстановителя в соединениях.
1. Межмолекулярные ОВР
Это такие реакции, в которых обмен электронами происходит между различными атомами, молекулами, ионами (окислитель и восстановитель находятся в разных молекулах, частицах).
Пример:
а) ![]()
С0 углерод повысил С.О. до +4 — это восстановитель.
O02 кислород понизил С.О. до —2 — это окислитель.
б) ![]()
Сl02 хлор понизил С.О. — это окислитель.
Вr- анион брома повысил С.О. — это восстановитель.
2. Реакции внутримолекулярного окисления и восстановления
ОВР внутримолекулярные — реакции, в которых окислитель и восстановитель находятся в одном и том же веществе (молекуле, частице).
Пример: ![]()
Азот в частице ![]() понижает С.О. — окислитель.
понижает С.О. — окислитель.
Кислород в частице ![]() повышает С.О. — восстановитель; они в одной молекуле KNO3 — нитрат калия.
повышает С.О. — восстановитель; они в одной молекуле KNO3 — нитрат калия.
Пример:
![]()
![]() — катион ртути, понижает С.О. — окислитель.
— катион ртути, понижает С.О. — окислитель.
![]() — анион кислорода, повышает С.О. — восстановитель.
— анион кислорода, повышает С.О. — восстановитель.
Они в одной молекуле — оксид ртути.
3. Реакции диспропорционирования (дисмутации)
Это реакции, где молекулы или ионы одного и того же вещества реагируют друг с другом как восстановитель и окислитель, вследствие того что содержащиеся в них атомы с переменными (промежуточными) С.О. отдают и принимают электроны переходя в состояния — один с низшей С.О., другой с высшей С.О.
Легкость реакции диспропорционирования связана с близостью внешнего энергетического уровня в состоянии атома.
Пример:
![]()
![]() в анионе
в анионе ![]() повышает С.О. в частице
повышает С.О. в частице ![]() — восстановитель.
— восстановитель.
![]() в анионе
в анионе ![]() понижает С.О. в частице
понижает С.О. в частице ![]() ,
, ![]() — окислитель.
— окислитель.
Пример:
![]()
![]() в молекуле NO2 повышает С.О. в частице
в молекуле NO2 повышает С.О. в частице ![]() — восстановитель.
— восстановитель.
![]() в молекуле NO2 понижает С.О. в молекуле
в молекуле NO2 понижает С.О. в молекуле ![]() — окислитель.
— окислитель.
Окислительно-восстановительные реакции могут протекать:
а) в растворах:
![]()
б) в газах:
![]()
в) с участием твердых веществ:
![]()
Значение ОВР
ОВР играют огромную роль в процессах обмена веществ в живых организмах. С ними связано дыхание, гниение, брожение, фотосинтез. В природе ОВР обеспечивают круговорот веществ, сгорание топлива, коррозии металла — это тоже ОВР. С их помощью получают щелочи, кислоты, соли, оксиды и многие другие важнейшие соединения, необходимые человечеству. ОВР лежат в основе преобразования энергии взаимодействующих химических веществ в электрическую энергию в аккумуляторах, гальванических элементах.
Обобщения и выводы по изученному материалу учитель делает вместе с учащимися, согласно узловым вопросам (по плану изложения).
II. Домашнее задание
§ 11. Из текста § 11 выписать ОВР всех типов (по 2 примера).
Ответы на вопросы самостоятельной работы
Вариант I
![]()
1. Реакции с изменением состава веществ — реакции замещения.
2. Реакция ОВР, т. к. элементы Al, Fe изменяют С.О.
3. Реакция экзотермическая, +Q.
4. Гомогенная, вещества в одном агрегатном состоянии.
5. Реакция необратимая: образуются два твердых вещества в виде осадка.
6. Реакция некаталитическая.
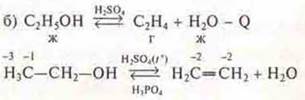
1. Реакция с изменением состава вещества — реакция элиминирования, реакция дегидратации.
2. Реакция ОВР — т. к. элемент С изменяет С.О.
3. Реакция эндотермическая, -Q.
4. Реакция — разное агрегатное состояние, гетерогенная.
5. Реакция обратимая, может идти и в прямом и в обратном направлении.
6. Реакция каталитическая, H2SO4 — катализатор прямой реакции. Н3РO4 — катализатор обратной реакции.
Вариант II
![]()
1. Реакция с изменением состава вещества:
ABC = АВ + ВС + В — реакция разложения.
2. Реакция ОВР, т. к. элементы О, N изменяют С.О.
3. Реакция эндотермическая: - Q.
4. Реакция гетерогенная, разные агрегатные состояния веществ.
5. Реакция необратимая, образуются газы, твердые вещества.
6. Реакция некаталитическая.
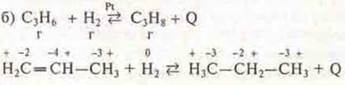
1. Реакция с изменением состава вещества — реакция присоединения, реакция гидрирования:
2. Реакция ОВР, т. к. С изменяет С.О.
3. Реакция экзотермическая: +Q.
4. Реакция гомогенная, т.к. вещества в одинаковом агрегатном состоянии.
5. Реакция обратимая.
6. Реакция каталитическая. Pt — катализатор.
IV. Закрепление изученного материала
1. Является ли реакция ОВР. Определить С.О. элементов, окислитель и восстановитель, тип ОВР.
![]()
а) реакция ОВР;
б) S-2 в H2S повышается С.О. в S0 — восстановитель H2S
S+4 в SO2 — понижает С.О. в S0 — окислитель SO2 — реакция межмолекулярная, окислитель и восстановитель в разных молекулах. Если в результате ОВР атомы одного и того же элемента получают в результате окисления и восстановления одинаковую С.О. — это реакция коммутации, она противоположна реакции диспропорционирования:
![]()