Поурочные разработки по химии 11 класс
Энергетика химических реакций - ХИМИЧЕСКИЕ РЕАКЦИИ - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: дать представление о причинах, вызывающих в химических реакциях выделение или поглощение энергии; углубить знания учащихся о законе сохранения энергии и превращении ее при химических реакциях; закрепить знания о тепловом эффекте, термических уравнениях реакций; научить выполнять расчет по термохимическим уравнениям.
Основные понятия: тепловой эффект, экзотермические-эндотермические реакции; термохимическое уравнение; энтальпия, теплота образования.
Оборудование: H2SO4 (и) Mg, лучина, малахит, прибор для электролиза раствора CuSO4, NH4SCN роданид аммония (HSCN, деревянная дощечка, роданистовод. кислота) штатив металлический, пробирки, термометр.
Ход урока
I. Организационный момент
Один из признаков классификации химических реакций — тепловой эффект. По этому признаку реакции делятся на экзо- или эндотермические. Задачей урока и является выяснение причин, вызывающих определенный тепловой эффект реакции. Для этого необходимо знакомство с законом сохранения энергии, превращением энергии в результате химических реакций, а также умение решать расчетные задачи по термохимическим уравнениям. Изучение нового материала будет убедительно доказываться экспериментами.
Вначале проведем проверку знаний учащихся, выполняя химический диктант, который выявит знания о признаках классификации химических реакций, а также знания определений типов химических реакций.
Задание: Дать определение типа химической реакции. Привести пример согласно признака классификации.
|
1) аллотропизация |
1) ОВР 2) изомеризация 3) обратимая 4) соединения 5) гетерогенная 6) эндотермическая |
|
2) гомогенные |
|
|
3) обмена |
|
|
4) замещения |
|
|
5) разложения |
|
|
6) экзотермическая |
II. Изучение нового материала
План изложения:
1. Причины, вызывающие выделением или поглощение энергии в химических реакциях. Тепловой эффект реакции.
2. Закон сохранения энергии М. В. Ломоносова. Превращение энергии химической реакции в тепловую, световую, механическую.
3. Термохимическое уравнение. Теплота образования. Энтальпия.
4. Вычисления по термохимическим уравнениям.
Вопрос. Каким общим признаком объединены следующие химические реакции: горение магния, горение спирта, взрыв тротила, реакция кислоты со щелочью, взаимодействие Na с водой, гашение извести, сжигание топлива?
Ответ. Все перечисленные химические реакции сопровождаются выделением энергии. Это экзотермические реакции. А общий признак фотосинтеза, крекинга углеводородов, гидролиза крахмала, превращения кислорода в озон, взаимодействия азота с кислородом — поглощение энергии. Это эндотермические химические реакции.
В чем же причина выделения и поглощения энергии?
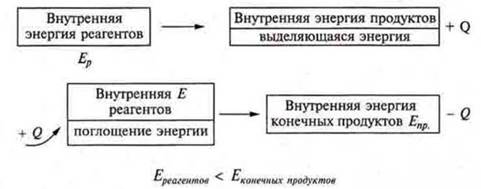
Вспомним еще раз, что же происходит с веществами, вступающими в реакцию? Во всех случаях происходит разрушение химических связей в молекулах реагирующих веществ и образование новых связей в конечных продуктах реакции.
Процесс разрушения химических связей происходит с поглощением энергии, а образование новых связей (мы это уже знаем) — с выделением энергии. Эти энергии не могут быть равны, т. к. внутренняя энергия реагентов отличается от энергии конечных продуктов реакции.
Для химических реакций учитывается та энергия, которая связана с движением электронов в атоме, их притяжением к ядру — т. е. энергия химической связи. Поэтому любая химическая реакция сопровождается либо выделением энергии, либо поглощением энергии. Согласно закону сохранения энергии, энергия не возникает из ничего и не исчезает бесследно, а только переходит из одной формы в другую. Этот закон сформулирован М. В. Ломоносовым (работа с учебником, рис. 23).
Горение метана и диаграмма изменения внутренней энергии вещества.
Это экзотермическая реакция, т. к. Евнут. > Епрод.
![]()
Разложение карбоната кальция и диаграмма изменения внутренней энергии:
Это изотермическая реакция. Значение Q называется тепловым эффектом реакции. Он по абсолютной величине одинаков для прямой и обратной реакции.
Формы выделения и поглощения энергии в химических реакциях разнообразны. Часто их бывает несколько, практически всегда тепловая.
Опыт 1. Растворение H2SО4 (конц.) в воде. Соблюдая правила ТБ, вливаем по стеклянной палочке серную кислоту в воду и аккуратно размешиваем. Термометр показывает повышение t °. Идет разогрев раствора.
Опыт 2. Аккуратно в ложке для сжигания веществ показываем горение магния, если нет этого металла, то показываем горение лучинки. Энергия выделяется в виде тепла и света экзотермическая реакция.
Опыт 3. Малахит (СаOН)2СO3 может разлагаться при нагревании, т. е. при поглощении тепла извне. Признаки разложения: вода, газ, изменение цвета. Эндотермическая реакция.
Опыт 4. Провести электролиз раствора CuSO4 на графитовых электродах. Это пример перехода электрической энергии в энергию химической реакции.
![]()
Опыт 5. Получение СO2, большого объема, который совершает механическую работу и выталкивает пробку, которой закрыта колба.
Опыт 6. Растворение роданида аммония NH4SCN — сильно эндотермический процесс. В стакан внести 50 г роданида аммония, стакан поставить на плотный лист бумаги или деревянную доску, смоченную водой, добавляем 50 мл воды и размешиваем. Через 1—2 мин стакан примерзнет к бумаге (доске). Можно использовать соль нитрат аммония NH4NO3.
Итак, тепловой эффект химической реакции — важнейший энергетический показатель и его часто вводят в уравнение химической реакции.
С + O2 = СO2 + Q — реакция с тепловым эффектом, + Q — экзотермическая
С + O2 = СO2 + 394 кДж — в уравнении указан тепловой эффект, 394 кДж теплоты выделяется при сгорании 1 моль углерода, т. е. 12 г
Уравнение, в котором указан тепловой эффект, называется термохимическим уравнением.
В зависимости от агрегатного состояния реагирующих веществ и конечных продуктов реакции, тепловой эффект одной и той же реакции будет отличаться.
![]()
Q1
Q1 < Q2, так как ![]()
1) Вычислить тепловой эффект химической реакции можно, зная энергию химических связей соединения.
Пример. Учебник стр. 119.
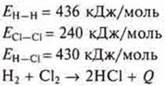
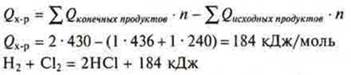
Тепловой эффект химической реакции всегда равен сумме теплот образования всех конечных продуктов реакции минус сумма теплот образования всех исходных продуктов, с учетом коэффициентов в уравнении.
Если вещество немолекулярного строения как определить, какие связи участвуют в химической реакции и разрушаются? Следует в этом случае знать, что для расчетов теплового эффекта реакции используются значение теплот образования всех веществ, участвующих в реакции. Теплота образования Qобр. — это тепловой эффект реакции образования одного моля вещества из простых веществ в стандартных условиях (t° = 25 °С, Р = 1 атм)
![]()
Так как каждое вещество обладает определенным запасом внутренней энергии, которая включает энергию образования частиц, энергию движения частиц, энергию их взаимодействия, способных совершать механическую работу, следует ввести понятие энтальпия H.
Энтальпия — сумма всех видов энергии вещества, полное его энергосодержание, измеряется Дж и кДж. Измерить точно энтальпию нельзя, так как невозможно учесть энергию всех частиц, можно лишь судить об изменении системы по тепловому эффекту химической реакции. Следует запомнить — изменение энергии системы ДН° (при t° = 25 °С, Р = 1 атм) всегда численно совпадает с тепловым эффектом, но противоположно по знаку: ΔН° = -Q.
Пример:
![]()
т. к. ΔН° = -Q, следовательно, термохимическое уравнение химической реакции
N2 + 3Н2 = 2NH3 + 92 кДж.
По термохимическим уравнениям можно проводить расчеты.
Задача 1. Сколько теплоты выделяется при сгорании угля массой 2,4 г, если тепловой эффект реакции равен +394 кДж?
Составляем термохимическое уравнение реакции и решаем по алгоритму любого расчета по уравнению
![]()
![]()
Составляем пропорцию:
![]()
Ответ: при сгорании 2,4 г С выделяется 78,8 кДж.
Задача 2. Составьте термохимическое уравнение образования воды (1 моль газообразной) из простых веществ, зная, что при образовании 9 г воды выделилось 123 кДж теплоты.
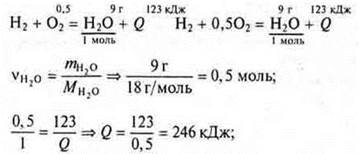
термохимическое уравнение на 2 моль воды:
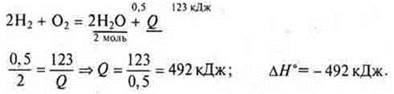
III. Обобщения и выводы по изученному материалу
Причиной выделения и поглощения энергии в химических реакциях является энергосодержание веществ, вступающих в реакцию и образующихся в результате реакции. Энергосодержание веществ характеризуется понятием «энтальпия».
Термохимическое уравнение реакции — запись уравнения, где указан либо типовой эффект, либо ΔН°; а т. к. ΔH° = -Q, можно выяснить, какая реакция по тепловому эффекту — экзо- или эндотермическая. Зная теплоты образования веществ, можно вычислить Q химической реакции.
По термохимическим уравнениям можно проводить расчеты, решать задачи.
IV. Домашнее задание
§ 12. № 1, 2, 3 (расчетные задачи).
V. Закрепление
Приступить к решению задач домашнего задания.