Поурочные разработки по химии 11 класс
Скорость химических реакций - ХИМИЧЕСКИЕ РЕАКЦИИ - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: углубить и обобщить теоретические знания учащихся о скорости химической реакции; закрепить знание формул выражения скорости реакций, гомогенной и гетерогенной, ее зависимости от энергии активации: научить выполнять расчеты, используя данные формулы.
Основные понятия: скорость химической реакции, энергия, химическая кинетика.
Оборудование: Mg, Zn, соляная кислота.
Ход урока
I. Организационный момент
Учитель напоминает учащимся угловые вопросы прошлого урока. Идет проверка решения расчетных задач, § 12 № 1, 2, 3. Для решения задач к доске вызываются три ученика.
II. Фронтальный опрос
1) В чем причина выделения и поглощения тепла в химических реакциях?
Ответ: Причина лежит в следующем: идет разрыв химических связей в молекулах реагирующих веществ — затрата энергии извне и образование новых связей в молекулах конечных продуктов реакции — выделение энергии.
2) Какие реакции называются экзотермическими?
Ответ. Если Еисходных продуктов > Еконечных продуктов, выделяется тепло (+ Q) — экзотермическая реакция.
Пример: горение магния: Mg + О2 = 2MgO + Q.
3) Какие реакции называются эндотермическими?
Ответ: Если Еисходных продуктов < Еконечных продуктов, тепло поглощается (- Q) — реакция эндотермическая.
Пример: СаСO3 = СаО + СO2 — Q.
4) Что такое тепловой эффект химической реакции?
Ответ: Количество теплоты, которое выделяется или поглощается в результате реакции, указано значением — есть тепловой эффект.
5) Какие химические уравнения называются термохимическими?
Ответ: Уравнения химических реакций, в которых записывается величина теплового эффекта, называются термохимическими. В термохимических реакциях тепловой эффект реакции относится к мольным количествам исходных веществ и продуктов реакции.
Пример: ![]()
Это термохимическое уравнение показывает, что при взаимодействии 1 моль азота с тремя моль водорода образуется два моль аммиака и выделяется 92 кДж. Чтобы показать тепловой эффект при образовании 1 моль продукта реакции, в термохимических уравнениях можно применять и дробные коэффициенты. Данное уравнение можно записать так:
![]()
Далее обсуждаются решения расчетных задач § 12.
Задача 1. Уравнение реакции горения этилена.
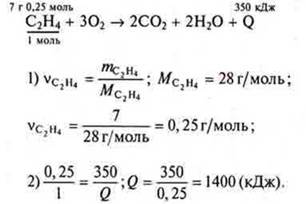
Ответ: тепловой эффект реакции 1400 кДж.
![]()
Задача 2.
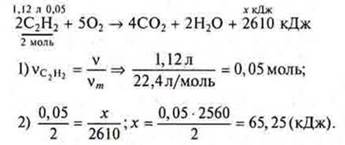
Ответ: при использовании 1,12 л ацетилена выделится 65,25 кДж.
Задача 3. Составляется уравнение реакции:
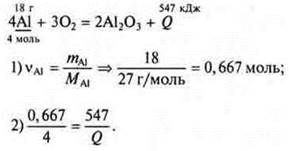
![]() — на образование 2 моль Аl2O3.
— на образование 2 моль Аl2O3.
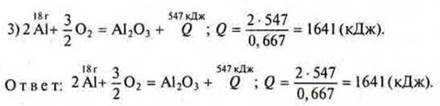
III. Изучение нового материала
План изложения
1. Понятие «скорость химической реакции». Формула выражения скорости гомогенной и гетерогенной реакции.
2. Энергия активации. Возможность протекания химических реакций в зависимости от энергии активации.
3. Решение расчетных задач.
Понятие скорости реакции для нас не новое. В 8 классе мы изучили данный вопрос, знаем формулы выражения скорости реакций гомогенной и гетерогенной, а также факторы, вызывающие изменение скорости реакции.
Проведем эксперимент. Сравним скорости реакции взаимодействия соляной кислоты с металлами Mg и Zn. По восстановительной способности магний активнее цинка, что мы и наблюдаем в данном эксперименте.
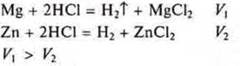
Скорость вытеснения водорода в реакции магния с кислотой больше, чем в реакции цинка с кислотой.
Что же происходит в результате реакции?
В результате взаимодействия изменяются количества веществ как реагирующих, так и образующиеся в определенном объеме и за определенный промежуток времени. Наука, занимающаяся закономерностями протекания химических реакций во времени, предсказывающая скорость химической реакции, выясняющая ее зависимость от условий проведения, называется химической кинетикой.
В зависимости от того, в какой фазе находятся вещества в данной химической реакции, они называются гомогенными и гетерогенными. Если однородная фаза — реакция гомогенная, и гетерогенная — если фаза неоднородная. Формулы выражения скорости таких реакций отличаются.
Скорость гомогенной реакции определяется изменением количества вещества в единицу времени в единице объема.
Vгомог. — скорость гомогенной реакции;
Δv — изменение количества молей одного из реагирующих веществ (моль);
Δt — интервал времени (сек, мин);
К — объем газа или раствора (л).
Поскольку ![]() отношение изменения количества вещества в единицу объема, представляет молярную концентрацию. Таким образом скорость гомогенной реакции определяется изменением концентрации одного из веществ в единицу времени:
отношение изменения количества вещества в единицу объема, представляет молярную концентрацию. Таким образом скорость гомогенной реакции определяется изменением концентрации одного из веществ в единицу времени:
![]()
Если реакция идет между веществами в разных агрегатных состояниях (твердое — жидкость, твердое — газ) или между веществами, не способными образовывать гомогенную среду (две несмешивающиеся жидкости), то она проходит только на поверхности соприкосновения веществ. Такие реакции называются гетерогенными.
Скорость гетерогенной реакции определяется как изменение количества вещества в единицу времени на единицу площади (поверхности):
![]()
S — площадь соприкосновения веществ (м2, см2).
Скорость реакции не является величиной постоянной. Она определяется лишь в определенном интервале времени, как средняя, а также зависит от того, изменением концентрации какого вещества она вычисляется.
Пример. Н2 + Сl2 = 2НСl.
Если определять скорость реакции по изменению концентрации водорода, то по уравнению следует, что из 1 моль водорода образуется 2 моль хлороводорода, в случае определения скорости реакции по изменению концентрации хлороводорода, то во втором случае она окажется больше в два раза.
Все процессы химических реакций осуществляются на микроуровне; чтобы частицы молекул, атомы реагирующих веществ прореагировали, они должны «столкнуться» эффективно, чтобы разрушились «старые связи» и смогли образоваться «новые». Для этого необходима энергия.
Максимальный избыток энергии, который должна иметь частица (или пара частиц), чтобы произошло эффективное соударение, называется энергией активации Еа.
Таким образом, частицы, вступающие в реакцию, должны преодолеть энергетический барьер, который равен Еа. Если Еa мала, то и скорость реакции велика, в противном случае необходим «толчок», необходимо приобрести дополнительную энергию за счет нагревания, вспышки света, механического удара.
Е активации эндотермических реакций больше, чем у реакций экзотермических. Поэтому для протекания эндотермических реакций требуется больше затрат энергии. Многие реакции практически не идут, т.к. требуют высокой Еа. Все это имеет большое значение в нашей жизни. Если бы все реакции могли идти, не имея энергетического барьера — Еа, то кислород воздуха прореагировал бы со всеми веществами, которые могут гореть или просто окисляться. Вследствие этого пострадали бы все органические вещества, они окислились бы до конечных продуктов СO2 и Н2O. Следовательно, мы существуем благодаря наличию Еа, которая не позволяет реакциям идти со значительной скоростью. Если Eа очень мала, в случае ионных реакций, реакции идут при обычных условиях мгновенно.
Для учащихся, которые более углубленно изучают химию, готовятся поступать в вуз, рекомендуется прочитать и разобрать в § 13, как протекают химические реакции учитывая Еа.
IV. Решение расчетных задач
На уроке необходимо объяснить учащимся решение расчетных задач с применением формул гомогенной и гетерогенной реакции.
Задача 1. Вычислить скорость химической реакции, протекающей по уравнению А(r) + В(r) = 2АВ(r).
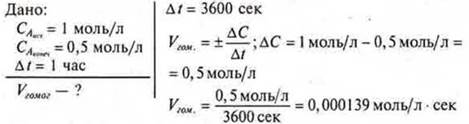
Ответ: изменение концентрации в секунду = 0,000139.
3адача 2. Чему равна средняя скорость реакции А + В = С, если начальная Св = 0,84 моль/л, а через 20 сек стало 0,62 моль/л?
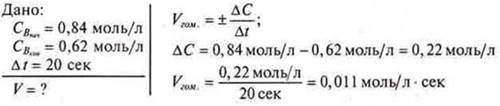
Ответ: Vcpeд.гом. = 0,011 моль/л сек.
Обобщения и выводы.
III. Домашнее задание
П/д § 13 (до факторов) (конспект).
Задача 3. В начальный момент времени концентрация исходного вещества (х) была равна 2 моль/л. Определить концентрацию вещества (х) через одну минуту, если скорость реакции равна 0,01 моль/л · сек.

Ответ: Сх кон. = 1,4 моль/л сек.