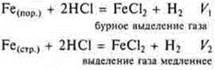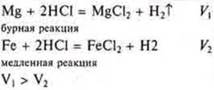Поурочные разработки по химии 11 класс
Практическая работа № 2 по теме «Скорость химических реакций. Химическое равновесие» - ХИМИЧЕСКИЕ РЕАКЦИИ - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: совершенствовать практические умения и навыки в выполнении химического эксперимента (работа со спиртовкой, нагревание вещества в открытом пламени, работа с растворами электролитов), соблюдая правила ОТ и ТБ; экспериментально убедиться во влиянии температуры природы реагирующих веществ, катализатора, поверхности соприкосновения на: а) скорость химических реакций, б) смещение химического равновесия.
Оборудование: крахмальный клейстер, раствор I2; раствор КI (0,4%), Fe — порошок и стружка; НСl; CuSO4 (раствор); СuСL2 (раствор); Zn (гран.), лучинка, FeCl3; KNCS, КСl (крист.), по 4 пробирки, спиртовка, спички, держатель.
Ход урока
I. Организационный момент
Инструктаж ОТ и ТБ, инструктаж последовательности выполнения работы.
II. Выполнение практической работы
Задание 1. Влияние факторов на скорость химических реакций:
а) поверхность соприкосновения реагирующих веществ.
Провести эксперимент между раствором соляной кислоты и металлом железо, взятым в виде стружки и порошка.
Сравнить скорости реакции. Дать обоснованный ответ.
б) температура. Провести эксперимент между растворами KI и Н2O2 без нагревания и при нагревании. Отметить время изменения цвета раствора. Сделать обоснованные выводы.
Н2O2 — пероксид водорода; KI — 0,4 %-ный раствор KI; (C6H10O5)n — крахмальный клейстер (его предварительно можно смешать с раствором KI).
в) природа реагирующих веществ. Экспериментально сравнить скорости реакции взаимодействия металлов Mg и Fe с соляной кислотой. Дать обоснованный ответ;
г) катализатор. Экспериментально сравнить скорости реакции взаимодействия гранулы цинка с раствором CuSO4 и СuСl2. Дать обоснованный ответ.
Задание 2. Влияние определенных факторов на смещение химического равновесия.
а) фактор — изменение концентрации реагирующих веществ и конечных продуктов. Экспериментально убедиться на опыте взаимодействия растворов FeCl3 и KNCS. В четыре пробирки налить по 1 мл воды, добавить 1—2 кап. FeCl3 и 1 —2 кап. KNCS. Отметить наблюдаемые явления. Затем в пробирку № 1 добавить 1—2 кап. FeCl3; в пробирку № 2 — 1—2 кап. CNCS, в пробирку № 3 — тв. КСl, пробирка № 4 остается для сравнения. Отметить необходимые явления. Дать обоснованный ответ;
б) фактор — температура.
Экспериментально убедиться о влиянии температуры на смещение равновесия реакции взаимодействия крахмального клейстера и раствора I2. Дать обоснованный ответ.
III. Оформление практической работы в таблице:
|
Задание |
Наблюдения, уравнения реакции |
Выводы |
|
|
|
|
IV. Домашнее задание: повторить § 11 — 14; подготовиться к зачету.
Ответы на вопросы заданий практической работы № 2
|
Задание |
Наблюдения, уравнения реакций |
Выводы |
|
Задание № 1. Влияние определенных факторов на скорость химических реакций |
||
|
а) поверхность соприкосновения реагирующих веществ. Эксперимент: — HCl и Fe(пор.); — HCl и Fe(стр.) |
|
V1 > V2, так как по формуле
S — единица площади Fe(пор.) меньше единицы площадиFe(стр.) |
|
б) температура: смесь KI и Н2О2 (крахмальный клейстер без t°) |
(крахмальный клейстер, наблюдается медленное изменение цвета — переход в синий) |
I2 вызывает посинение крахмала медленно |
|
KI и Н2O2 (крахмальный клейстер при t°) |
моментальное посинение раствора
|
ОВР при t° идет очень быстро, так как Еакт. уменьшается |
|
в) природа реагирующих веществ: Mg(пор.) и НСl Fе(пор.) и НСl |
|
Радиус атома Mg больше радиуса атома железа, восстановительная способность Mg больше восстановительной способности Fe, атомам Mg требуется Е0 меньше |
|
г) катализатор: сравнить две реакции Zn и CuSO4 Zn и CuCl2 (3—4 кап.) CuSO4 |
наблюдается появление мели, реакция идет с небольшой скоростью |
Восстановительная способность Zn больше восстановительной способности Сu, Zn вытесняет Сu из раствора соли |
|
наблюдается появление меди, однако реакция идет очень быстро |
В растворе соли
в результате диссоциации присутствуют анионы Сl-, которые выступают в роли катализатора, скорость реакции большая V2 > V1 |
|
Задание 2. Влияние определенных факторов на смешение химического равновесия
|
а) фактор — изменение концентрации реагирующих веществ и конечных продуктов |
Пробирки |
цвет комплексной соли К3 [Fe(NCS)6] светло-красный |
|||
|
№ 1 H2O 1-2 к FeCl3 1-2 к KNCS |
№ 2 H2O 1-2 к FeCl3 1-2 к KNCS |
№ 3 H2O 1-2 к FeCl3 1-2 к KNCS |
№ 4 H2O 1-2 к FeCl3 1-2 к KNCS |
||
|
цвет светло-красный |
|
||||
|
|
далее добавляем 1-2 к FeCl3 |
В пробирке № 1 цвет усилится |
|||
|
|
№ 1 |
№ 2 |
№ 3 |
№ 4 |
|
|
|
|
|
|
исходныйпродукт |
Так как концентрация FeCl3 увеличена, равновесие смешается в сторону образования К3[Fe(NCS)6] |
|
|
|
добавим 1-2 кKNCS усилился цвет |
|
|
Усилился цвет в пробирке № 2 по той же причине - равновесие смещается в сторону образования конечного продукта идет прямая реакция |
|
|
|
|
добавим KCl(кр.), цвет раствора стал желтый |
для сравнения |
Увеличена концентрация конечного продукта, равновесие смещается в сторону образования исходных продуктов, т. е. идет обратная реакция |
|
б) температура крахмальный клейстер и раствор I2 |
При обычной температуре
темно-синее окрашивание |
Образуется соединение амиразы с молекулами I2, цвет темно-синий, реакция экзотермическая |
|||
|
крахмальный клейстер и раствор I2 при нагревании |
Нагреем темно-синий раствор — цвет исчезает, т. к.
Наблюдается появление темно-синего цвета раствора при охлаждении |
При нагревании равновесие смещается в сторону эндотермической реакции, идет обратная реакция |
|||
Выводы: Эксперименты убедительно доказали влияние определенных факторов на скорость химических реакций и на смещение химического равновесия. Дополнительно: влияние и температуры, и катализатора на скорость реакции. В случае влияния катализатора и t° на скорость реакции возможно проведение реакции разложения Н2O2:
а) при нагревании без катализатора
![]()
б) при нагревании и в присутствии катализатора МnO2
![]()
Выделение кислорода можно доказать тлеющей лучиной.