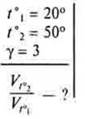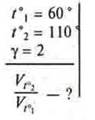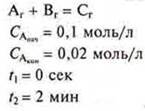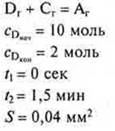Поурочные разработки по химии 11 класс
Обратимость химических реакций. Химическое равновесие. Условия смещения химического равновесия по принципу Ле Шателье - ХИМИЧЕСКИЕ РЕАКЦИИ - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: закрепить понятия «обратимость» и «необратимость» химических реакций; обобщить и углубить знания учащихся о химическом равновесии, константе равновесия, знать принцип Ле Шателье и уметь применять его для смещения химического равновесия; дать представление о значении знаний о химическом равновесии в производстве и в природе, развитие навыков в решении расчетных задач с использованием понятия «константа равновесия».
Основные понятия: обратимые и необратимые химические реакции, химическое равновесие, равновесные концентрации, константа равновесия, скорость реакции, принцип Ле Шателье.
Оборудование: растворы FeCl3; KNCS — роданид калия; KCl — кристалл; крахмальный клейстер; пробирки, вода, спиртовка, спички, держатель.
Ход урока
I. Фронтальный опрос
1. Определение скорости химической реакции.
2. Формулы выражения скорости и единицы измерения скорости:
а) гомогенной реакции;
б) гетерогенной реакции.
3. Перечислить факторы, влияющие на скорость химической реакции.
4. На примере реакции взаимодействия цинка (гр) с кислотами соляной и уксусной объяснить влияние
а) природы реагирующих веществ на скорость реакции;
б) температуры на скорость химической реакции: формулы Вант-Гоффа;
в) поверхности соприкосновения реагирующих веществ на скорость химической реакции; сравнить скорость реакции железа в виде порошка и железа в виде стружки с соляной кислотой.
5. Как зависит скорость химической реакции от концентрации? Закон масс действующих реагирующих веществ. Составить кинетическое уравнение химической реакции.
Пример.
![]()
6. Какие вещества называются катализаторами? Ингибиторами? В чем отличие их действия на скорость химической реакции? Значение катализаторов и ингибиторов на производстве, в жизни живых организмов.
7. Что нужно знать о химической реакции, чтобы определить ее скорость? Выбрать правильные ответы.
а) тип реакции;
б) состав и агрегатное состояние исходных продуктов и конечных продуктов реакции;
в) концентрацию всех исходных продуктов реакции;
г) концентрацию одного продукта реакции через определенный промежуток времени и величину промежутка времени;
д) температурный коэффициент, изменение температуры за определенный промежуток времени;
е) площадь поверхности соприкосновения; наличие катализатора.
Ответы предварительно записать на обратной стороне доски.
Ответы на вопросы фронтального опроса
б) состав и агрегатное состояние исходных и конечных продуктов реакции.
Выяснить, является ли реакция гетерогенной или гомогенной, т. к. формулы вычисления скорости реакции для них разные, для гомогенной — ![]() для реакции в общем виде аА + bВ = С.
для реакции в общем виде аА + bВ = С.
При вычислении скорости по закону действующих масс не учитывать вещества в твердом состоянии, а также несмешивающиеся жидкости.
![]()
в) концентрации всех исходных продуктов реакции, т. к. скорость реакции прямопропорциональна концентрации реагирующих веществ (для гомогенных реакций).
г) скорость определяется по формуле ![]() ΔC определяется разностью начальной и конечной концентрации одного из реагирующих веществ. Δt — промежуток времени изменения концентрации.
ΔC определяется разностью начальной и конечной концентрации одного из реагирующих веществ. Δt — промежуток времени изменения концентрации.
д) температурный коэффициент у для каждой реакции известен, он необходим при вычислении изменения скорости реакции в результате повышения или понижения температуры по закону Вант-Гоффа ![]()
е) поверхность соприкосновения реагирующих веществ учитывается в гетерогенных реакциях по формуле ![]()
Чем более раздроблено вещество, тем меньше единица площади, тем больше скорость реакции. Катализатор — ускоритель. Вещество, повышающее в конечном итоге скорость реакции, но само не расходуется. Действие ингибитора противоположно действию катализатора.
Катализаторы — вещества, изменяющие механизм реакции и направляющие ее в более выгодное направление по энергии — меньшей Еa. Они не изменяются качественно и количественно.
II. Самостоятельная работа
|
Вариант I |
Вариант II |
|
1. Составить выражение скорости химической реакции по закону действующих масс. |
|
|
|
|
|
2. Как изменится скорость реакции по условию задачи, уменьшится или увеличится? |
|
|
|
|
|
3. Вычислить скорость |
|
|
гомогенной реакции |
гетерогенной реакции |
|
по условию: |
|
|
|
|
|
Провести самопроверку. |
|
Ответы на вопросы самостоятельной работы
Вариант I
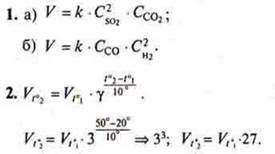
Ответ: скорость реакции возрастет в 27 раз.
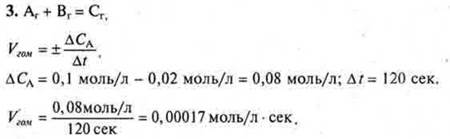
Ответ: Vгом. = 0,00017 моль/л · сек.
Вариант II
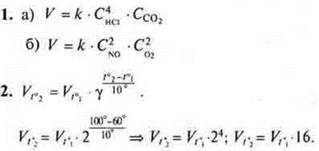
Ответ: скорость реакции возрастет в 16 раз.
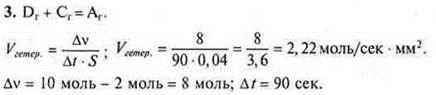
Ответ: Vгетер. = 2,22 моль/сек · мм2.
II. Изучение нового материала
План изложения:
1. Реакции необратимые и обратимые. Признаки необратимости.
2. Химическое равновесие. Константа химического равновесия.
3. Факторы, вызывающие смешение химического равновесия. Принцип Ле Шателье. Эксперимент.
4. Решение расчетных задач темы.
Задание: Из предложенных уравнений химических реакций выбрать реакции:
а) необратимые;
б) обратимые.
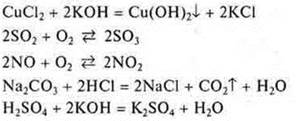
Необратимые реакции имеют признаки необратимости:
![]() — выпал осадок.
— выпал осадок.
![]() — образовался слабый электролит, который разлагается на воду и углекислый газ.
— образовался слабый электролит, который разлагается на воду и углекислый газ.
![]() — образовалась вода — очень слабый электролит.
— образовалась вода — очень слабый электролит.
Остальные реакции при одних и тех же условиях могут протекать как в прямом, так и в обратном направлении. Являются обратимыми.
![]()
Известно, что большинство реакций являются обратимыми. Если речь идет о замкнутой системе, то при определенных условиях необратимая реакция становится обратимой.
Пример:
а) в открытой системе реакция ![]() — необратимая;
— необратимая;
б) в замкнутой системе — она становится обратимой:
![]()
Рассмотрим более подробно процессы, протекающие при обратимых реакциях для условной реакции.
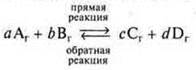
По закону действующих масс определим скорости прямой и обратной реакций.
![]() т. к. со временем СА и СВ уменьшаются, то и скорость прямой реакции уменьшается. Так как в результате прямой реакции образуются продукты С и D, а реакция обратимая, начинает увеличиваться скорость обратной реакции.
т. к. со временем СА и СВ уменьшаются, то и скорость прямой реакции уменьшается. Так как в результате прямой реакции образуются продукты С и D, а реакция обратимая, начинает увеличиваться скорость обратной реакции.
![]()
Наступает такой момент, когда скорости прямой и обратной реакции становятся равными: Vпр. = Vобр. а концентрации реагирующих веществ и конечных продуктов реакции остаются неизменными. Их называют равновесными концентрациями. Такое равновесие в системе называется подвижным или динамическим. Следует рассмотреть рис. 34 с. 142 учебника, где показаны графики изменения концентрации и скоростей реакций необратимых и обратимых.
Реакции необратимые — с увеличением времени концентрации исходных веществ уменьшаются до 0, а концентрация конечных продуктов возрастает. Скорость реакции уменьшается до 0. Реакции обратимые — концентрации исходных веществ уменьшаются, одновременно концентрации конечных продуктов реакции возрастает в определенный промежуток времени. Скорость прямой реакции уменьшается, скорость обратной реакции возрастают за такой же промежуток времени. Наступает момент выравнивания скоростей прямой и обратной реакций, а концентрации исходных продуктов и конечных продуктов реакции остаются неизменными.
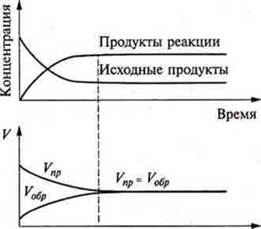
Состояние системы, при котором скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием.
Состоянию химического равновесия можно дать количественную характеристику, применяя закон действующих масс, через константу химического равновесия Кравн. — величина постоянная для данной обратимой реакции. Она показывает соотношение между концентрациями продуктов реакции (числитель) и исходных веществ (знаменатель), которое устанавливается при равновесии.
В случае химической реакции в общем виде
![]() равновесные концентрации веществ [А]; [В]; [C]; [D].
равновесные концентрации веществ [А]; [В]; [C]; [D].
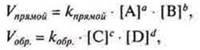
т. к. в момент химического равновесия
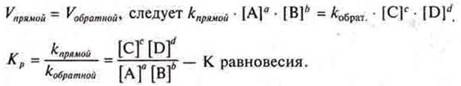
Если Кравн. > 1 — концентрации продуктов реакции преобладают над концентрацией исходных продуктов в прямой реакции, система направлена в сторону →
Если Кравн. < 1, концентрации исходных продуктов реакции преобладают над концентрацией конечных продуктов реакции, система направлена в сторону обратной реакции ←
Если Кравн. = 1, концентрация исходных продуктов реакции и конечных остаются неизменными, так как скорости прямой и обратной реакций равны, наступило химическое равновесие ![]()
В случае гетерогенных реакций в выражение константы равновесия входят концентрации веществ, которые находятся в газовой и жидкой фазе.
Пример: ![]()
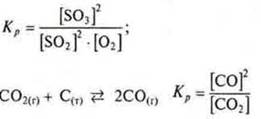
Значение константы равновесия зависит от природы реагирующих веществ и температуры. Катализатор понижает Еактивации и прямой и обратной реакции на одну и ту же величину и лишь только ускоряет наступление равновесия.
Состояние химического равновесия может сохраняться долго при неизменных внешних условиях: температуры, концентрации исходных веществ или конечных продуктов давления (если в реакции участвуют газы).
Если изменить эти условия, можно перевести систему из одного равновесного состояния в другое, отвечающее новым условиям.
Такой переход называется смещением или сдвигом равновесия. Управление смещения можно предсказать, пользуясь принципом Ле Шателье, 1884 г.
При воздействии на равновесную систему извне (изменить концентрацию, давление, температуру) равновесие смещается в сторону той реакции (прямой или обратной), которая ослабляет это воздействие.
1) Изменение концентрации:
а) если С конечных продуктов увеличиваем, равновесие смещается в сторону образования исходных продуктов, т. е. преобладает обратная реакция:
![]()
б) увеличиваем концентрацию исходных продуктов, равновесие смещается в сторону образования конечных продуктов, преобладает прямая реакция:
![]()
в) при уменьшении концентрации конечных продуктов реакция равновесия смещается в сторону их образования, преобладает прямая реакция:
![]()
г) при уменьшении концентрации исходных продуктов реакции равновесие смещается в сторону образования исходных продуктов реакции, преобладает обратная реакция:
![]()
2) Влияние изменения давления:
а) при увеличении давления равновесие смещается в сторону той реакции, при которой объем образовавшихся газообразных продуктов уменьшается:
Р↑ — в сторону наименьшего объема;
б) при уменьшении давления равновесие смещается в сторону той реакции, при которой объем образовавшихся газообразных продуктов увеличивается:
P↓ — в сторону наибольшего объема.
Пример. 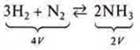
а) Р↑ — прямая реакция ![]() (прямая Р↑);
(прямая Р↑);
б) P↓ — обратная реакция ![]() (обратная P↓);
(обратная P↓);
в) если объемы газообразных продуктов одинаковы как в прямой, так и в обратной реакции — изменение давления не оказывает смещения равновесия.
Пример: 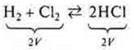
3) Влияние изменения температуры:
а) при повышении температуры химическое равновесие смещается в сторону эндотермической реакции.
t °↑ — в сторону - Q;
б) при понижении температуры химическое равновесие смещается в сторону эндотермической реакции.
t °↓ — в сторону + Q;
Пример. ![]()

Принцип Лe Шателье применим и к процессам испарения конденсации, плавления, кристаллизации. При производстве важнейших химических продуктов учитывают особенности химических реакций, особенно обратимых, и находят оптимальные условия, которые обеспечивают максимальный выход продукта.
Далее учащимся показывают эксперименты, доказывающие возможность смещения химического равновесия, применяя факторы:
а) изменение температуры.
Добавить в крахмальный клейстер раствор I2. Наблюдается посинение, т. к. к макромолекула крахмала — амилоза — реагирует с I2, образует окрашенный комплекс — молекула амилоза в виде спирали, окруженная молекулами йода. Около каждой молекулы I2 оказывается шесть глюкозных оснований. При нагревании этот комплекс разрушается и окраска исчезает при охлаждении — вновь образуется комплекс и окраска восстанавливается.
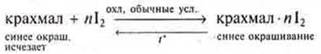
б) изменение концентрации исходных и конечных продуктов реакции.
В четыре пробирки добавить по 2 мл воды и 1—2 капли KNCS
(роданид) калия; и 1-2 капли ![]() раствор стал светло-красный во всех пробирках.
раствор стал светло-красный во всех пробирках.
![]()
В пробирку № 1 добавить 2-3 капли FeCl3 — цвет усиливается, идет прямая реакция → Vпрямой > Vобр.
В пробирку № 2 добавить 2-3 капли KNCS — цвет усиливается, идет прямая реакция → Vпрямой > Vобр.
В пробирку № 3 добавить КСl — цвет исчезает, идет обратная реакция ← Vпрямой < Vобр.
Пробирка № 4 — для сравнения.
III. Обобщения и выводы
Таким образом, на данном уроке мы более углубленно изучили химическое равновесие — которое может возникнуть в обратимых химических реакциях, а также получили представление о факторах, вызывающих смещение химического равновесия в сторону прямой или обратной реакции, экспериментально убедились в этом.
IV. Домашнее задание
§ 14, № 1—4, задачи № 7, 8.
V. Закрепление и решение расчетных задач
Задание. № 1(1) § 14.
![]()
![]()
![]() в сторону меньшего объема.
в сторону меньшего объема.
Задание. № 2 (1) § 14.
![]()
![]() в сторону меньшего объема.
в сторону меньшего объема.
Задача. 5 (1) § 14.
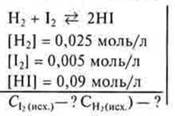
![]()
1) γH2 — израсходованного на получение 0,09 HI
![]()
![]()
2) γI2 — израсходованного на получение 0,09 НI
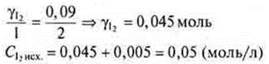
Ответ: СI2 исх. = 0,05 (моль/л); СH2 (исх.) = 0,07 (моль/л).