Поурочные разработки по химии 11 класс
Состояние электронов в атоме
Цели урока: закрепить знание понятий «электронное облако», «орбиталь», «энергетический уровень», «энергетический подуровень»; сформировать представления о квантовых числах, характеризующих энергию электрона в атоме, формы орбиталей, их количество и расположение в пространстве около ядра; научить описывать состояние электрона в атоме, используя квантовые числа.
Основные понятия: электронное облако, орбиталь, энергетический уровень, энергетический подуровень, квантовые числа — главное, орбитальное (побочное), магнитное, спимовое (при 2 часах химии в неделю ознакомить учащихся только с главным квантовым числом и научить использовать его для характеристики состояния электрона в атоме; однако если есть возможность ознакомить учащихся со всеми квантовыми числами, следует ее использовать, это поможет более правильно и намного понятнее в дальнейшем объяснять учащимся электронные конфигурации атомов).
Оборудование: ПСХЭ Д. И. Менделеева.
Ход урока
I. Организационный момент
Учитель вместе с учащимися проверяет правильность выполнения домашнего задания.
С остальными учащимися проводится фронтальный опрос по следующим вопросам:
1. Перечислите все открытия физики конца XIX—начала XX века, подтверждающие сложность строения атома.
2. Какие модели строения атома вам известны? В чем их несостоятельность?
3. Какие постулаты предложил Н. Бор? Почему его теория считается важнейшим этапом в развитии представлении о строении атома?
4. Объяснить двойственную природу частиц микромира.
5. В чем суть протонно-нейтронной теории ядра атома?
6. Указать элементарные частицы атома, их массу и заряд.
7. Как на основании положения элемента в ПСХЭ Д.И. Менделеева определить состав атома, заряд его ядра?
Данные вопросы можно написать на кодотранспоранте либо в распечатанном виде выдать учащимся. Все зависит от наличия TCO в школе.
Далее осуществляется проверка домашнего задания, выполненного учащимися на лоске.
II. Изучение нового материала
План изложения
1. Движение электрона в атоме. Электронное облако. Электронная орбиталь s-, р-, d-, f-.
2. Энергия электрона. Квантовые числа: главное, орбитальное (побочное), магнитное, спиновое. Характеристика состояния электрона в атоме квантовыми числами.
3. Энергетический уровень, энергетический подуровень. Физический смысл номера периода.
4. Характеристика состояния электронов в атоме элемента № 8.
Повторяем то, что уже известно:
— теория, занимающаяся изучением движения микрочастиц, называется квантовой механикой;
— электрон проявляет одновременно свойства и частицы, и волны;
— в соответствии с квантовой механикой движение электрона вокруг ядра атома нельзя рассматривать просто как механическое перемещение.
Согласно этой теории электрон может находиться в любой точке вблизи ядра атома, но вероятность его пребывания в различных точках неодинакова. Таким образом, если бы можно было наблюдать электрон в атоме, то увидели бы, что в одних местах он бывает чаше, а в других — реже. Поэтому электрон, двигаясь в атоме, образует так называемое электронное облако. Электронное облако — это объем пространства относительно ядра, в котором сосредоточена вся масса и весь заряд электрона. Электронная плотность электронного облака распределена неравномерно. У ядра она равна нулю. По мере удаления от ядра она увеличивается, а затем снижается. Объем пространства относительно ядра, в котором сосредоточено около 90 % электронной плотности, называется атомной орбиталью (АО). Расстояние от ядра до максимальной электронной плотности называется атомным радиусом. Энергия атомной орбитали зависит от ее радиуса. Чем больше радиус атомной орбитали, тем больше энергия. Атомные орбитали, имеющие одинаковый запас энергии и одинаковый радиус, образуют энергетический уровень в атоме. Номер периода химического элемента в ПСХЭ Д.И. Менделеева соответствует количеству энергетических уровней в атоме.
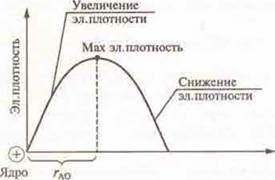
Пример:
![]()
Пример: Элементы VI периода в атоме имеют шесть энергетических уровней. Однако электроны одного энергетического уровня могут отличаться друг от друга энергией связи с ядром атома. На энергетическом уровне возникают подуровни. Количество подуровней на энергетическом уровне соответствует номеру энергетического уровня.
Пример: Номер энергетического уровня III, следовательно, возможно открытие трех подуровней.
Важным следствием из квантовой механики является то. что вся совокупность сложных движений электрона в атоме характеризуется энергетическими числами, которые называются квантовыми числами.
n — главное квантовое число, определяет общую энергию электрона данного энергетического уровня, принимает значения целых чисел натурального ряда — 1, 2, 3, ..., ∞.
Далее возможно объяснение состояния электрона в атоме учитывая только главное квантовое число. Необходима работа с таблицей учебника № 1. Данная таблица дает возможность определять в атоме химического элемента, учитывая только главное квантовое число, количество энергетических уровней, подуровней; вычислять число орбиталей в уровне и подуровне, а также рассчитывать максимальное число электронов на энергетическом уровне и подуровне.
Пример: n = 3; на третьем энергетическом уровне — подуровней — 3: 3s, 3p, 3d; число орбиталей в уровне: n2 — 9: в подуровнях: 3s — 1, 2р — 3, 3d — 5; максимальное число электронов в уровне 2n2— 18; на подуровнях: s — 2, р — 6, d — 10.
Учитывая то, что при дальнейшем изучении темы, особенно вопроса, связанного с электронными конфигурациями атомов химических элементов, невозможно обойтись только главным квантовым числом, на этом уроке необходимо ознакомить учащихся и с другими квантовыми числами. Тем более что многие вопросы тестов ЕГЭ требуют дать ответ, применяя знание квантовых чисел.
Итак, состояние электрона в атоме характеризуется квантовыми числами:
n — главное квантовое число (его характеристика нам уже известна);
l — побочное (орбитальное) квантовое число. Подуровни энергетического уровня характеризуются побочным квантовым числом. Оно зависимо от главного квантового числа и принимает значения от 0 до n - I.
Побочное квантовое число характеризует форму атомной орбитали и уточняет ее энергию по формуле E = n + l.
1. При l = 0 открывается подуровень s с s-орбиталыо, форма которой сферическая.
2. При l = 1 открывается подуровень р с р-орбйталями, форма которых напоминает объемную восьмерку.
3. При l = 2 открывается подуровень d с d-орбиталями, форма которых напоминает объемный лепесток и более сложную объемную восьмерку.
4. При l = 3 открывается подуровень f с f-орбиталями, имеющими более сложную форму.
Номер энергетического уровня соответствует количеству подуровней. При n = 3 — три подуровня; при n = 2 — два подуровня.
Количество орбиталей на подуровне определяется m — магнитным квантовым числом. Магнитное квантовое число определяет распределение орбиталей в магнитном поле ядра, оно зависимо от орбитального квантового числа и принимает значения от 0 до l - 1; m = 2l + 1.
Пример: при l = 0, ml = 0, орбиталь одна; при l = 1, m = -1, 0, +1, три орбитали.
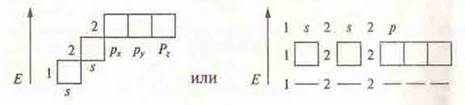
Следует отметить, что все орбитали располагаются симметрично в пространстве:
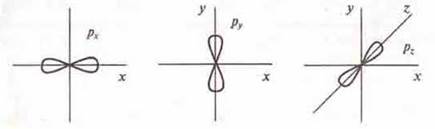
Атомные орбитали можно изображать ячейками или пунктирами:
Ячейкой ![]() или пунктиром
или пунктиром ![]()
s-подуровень: ![]() или
или ![]()
р-подуровень: ![]() или
или ![]()
d-подуровень:  или
или ![]()
f-подуровень:  или
или 
Спиновое квантовое число s — независимое. Это число — квантовое свойство электрона, не имеющее классических аналогов. Спин — это собственный момент импульса электрона, не связанный с движением в пространстве. Для всех электронов абсолютное значение спина 1/2. Проекция спина на ось (магнитное спиновое число ms может иметь лишь два значения: +1/2 или -1/2, т. к. спин электрона — величина постоянная.)
Вывод: Состояние электрона в атоме характеризуется квантовыми числами: n — главное квантовое число, l — побочное квантовое число, ml — магнитное орбитальное квантовое число,ms — магнитное спиновое квантовое число.
Зная квантовые числа у электрона, можно описать энергию, количество орбиталей, их форму и расположение в пространстве.
III. Закрепление изученного материала
Задание: Описать состояние электронов в атоме химического элемента № 8, используя все квантовые числа.
Ответ: Элемент № 8 — кислород, заряд ядра атома +8, в атоме 8 электронов. Кислород расположен во II периоде, n = 2. следовательно, в атоме кислорода электроны распределены по запасу энергии на двух энергетических уровнях.
Первый энергетический уровень, n = 1.
l = 0; s-подуровень; 1s
ml = 0: одна s-орбиталь. ![]()
Второй энергетический уровень; n = 2; l = 0, 1;
l = 0; s-подуровень; 2s
ml = 0 ⇒ одна орбиталь. ![]()
l = 1; подуровень; 2р
ml = +1, 0, -1 ⇒ три орбитали; ![]()
IV. Домашнее задание
Описать состояние электронов и атоме химических элементов № 3, 16, 5, 14, 2; вопросы 1, 2, 4, 5, 6 (устно).