Поурочные разработки по химии 11 класс
Электронные конфигурации атомов химических элементов и графическое изображение электронных конфигураций атомов
Цели урока: научить составлять электронные формулы атомов химических элементов и их графические конфигурации на основании правил и принципов дополнения электронных оболочек атомов: закрепить знание электронной классификации элементов: s-, р-, d-, f-семейство.
Основные понятия; электронная формула, графическая конфигурация электронной формулы, спаренные и неспаренные электроны, принцип Паули, правило Хунда (Гунда), правило Клечковского, формула распределения, формула заполнения; симметрия атома.
Оборудование: ПСХЭ Д.И. Менделеева; таблицы электронного строения атомов химических элементов.
Ход урока
I. Организационный момент
Постановка целей и задач урока.
II. Проверка правильности выполнения домашнего задания
Учащимся необходимо было дать характеристику элементов № 3, 16, 5, 14, 2.
Характеристику элементов учащиеся объясняют с места (проговаривая).
1) Элемент № 3. Литий, заряд ядра +3, электронов в атоме 3, n = 2, в атоме два энергетических уровня: n = 1, первый энергетический уровень;
l = 0; один подуровень; s — подуровень;
ml = 0, одна орбиталь, сферическая.
1s; 1![]()
n = 2, второй энергетический уровень l = 0,1; l = 0, s — подуровень; ml = 0, одна орбиталь 1s; 1![]()
l = 1; р — подуровень, ml = +1, 0, -1; три орбитали.
![]() форма объемных восьмерок.
форма объемных восьмерок.
Элемент № 16. Сера, заряд ядра атома +16, в атоме 16 ē.
n = 3, в атоме три энергетических уровня:
n = 1, первый энергетический уровень;
l = 0 — s-подуровень;
ml = 0 — одна орбиталь, сферическая.
1s; 1![]()
n = 2, второй энергетический уровень;
l = 0,1; два подуровня;
l = 0 — s-подуровень;
ml = 0 — одна сферическая орбиталь.
2s; 2![]()
l = 1; p — подуровень;
ml = +1, 0, -1; три орбитали, объемные восьмерки.
2p; 2![]()
n = 3, третий энергетический уровень:
l = 0, 1, 2 — три подуровня;
l = 0; s-подуровень;
ml = 0, одна орбиталь, сферическая.
3s; 3![]()
l = 1, p-подуровень;
ml = +4, 0, -1; три орбитали; объемные восьмерки.
3р; 3![]()
l = 2, d-подуровень;
ml = +2, +1, 0, -1, -2 — пять орбиталей более сложной формы.
3d; 3![]()
Можно записать и так:
Характеристику элементов № 5. № 14 учащиеся выполняют у доски (записывают кратко). Учащиеся класса обсуждают ответы на вопросы § 2.
№ 1
Электрон в атоме не имеет траектории движения, т.е. можно говорить лишь о вероятности нахождения его в пространстве вокруг ядра.
№ 2
Электронное облако — объем пространства относительно ядра, в котором сосредоточена вся масса и весь заряд е-.
Орбиталь — атомная орбиталь, объем пространства вокруг ядра, в котором сосредоточено около 90% электронной плотности.
№ 4
2s-орбиталь имеет большой радиус по сравнению с 1s, а чем больше радиус АО, тем больше энергия: EAO1s < ЕAO2s.
№ 5
Главное квантовое число определяет общую энергию электрона на данном энергетическом уровне. Номер периода соответствует количеству энергетических уровней в атоме химического элемента.
№ 6
Электроны энергетического уровня отличаются друг от друга энергией связи с ядром атома, вследствие чего возникают подуровни. Номер периода соответствует количеству подуровней на данном энергетическом уровне. Если бром расположен в IV периоде, то в его атоме четыре энергетических уровня, на четвертом энергетическом уровне четыре подуровня; заряд ядра атом брома +35, в атоме 35 электронов. Нам необходимо теперь выяснить, как электроны атома химического элемента, обладая определенным запасом энергии, которая характеризуется квантовыми числами, распределяются в атоме.
III. Изучение нового материала
План изложения
1. Принцип минимальной энергии, принцип Паули. Правило Хунда и следствие из него; правило Клечковского.
2. Формула распределения; формула заполнения.
3. Формулы заполнения — электронные формулы, графические — элементов I — III периодов.
4. Формулы заполнения (электронные и графические) элементов больших периодов.
5. Семейства химических элементов.
6. Симметрия атома химического элемента.
Электронная формула — запись строения атома посредством электронных уровней, подуровней.
Для правильного заполнения электронами АО необходимо знать следующее: электрон занимает тот энергетический уровень, тот подуровень или ту АО, которым соответствует минимальный запас энергии.
Это — принцип минимальной энергии.
Следовательно, заполняется тот энергетический уровень, тот подуровень, та АО, которая ближе к ядру: 1s, 2s, 2р, ...
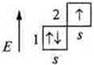
Принцип Паули. В атоме не может быть двух е- (электронов), у которых все четыре квантовых числа охарактеризованы одинаковыми значениями. Хотя бы одним значением квантового числа электроны должны отличаться. Из этого принципа следует следствие: в одной АО могут находиться не более двух электронов, охарактеризованных различными значениями спинового квантового числа.
Пример: Дана электронная формула атома химического элемента.
1s2; n = 1; l = 0 один подуровень, s;
ml = 0 одна орбиталь, сфера;
![]()
электроны заполняют s-проуровень АО; записывается графическая конфигурация электронной формулы.
Орбиталь рисуем ячейкой, электрон — вектором.
![]() — по принципу Паули.
— по принципу Паули.
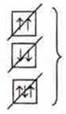 вопреки принципу Паули.
вопреки принципу Паули.
Правило Хунда (Гунда). При распределении электронов в подуровнях р-, d-, f- следует помнить, что суммарный спин был максимальным.
Пример:
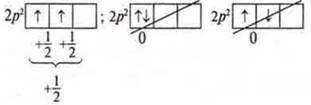
2p3-подуровень
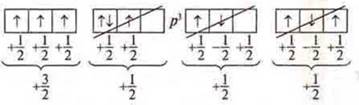
Следствие из правила Хунда.
Электроны сначала по одному занимают все АО, а потом идут на спаривание.
![]() — неспаренные электроны (по одному на АО).
— неспаренные электроны (по одному на АО).
![]() — спаренные электроны (по два на АО)
— спаренные электроны (по два на АО)
![]() — одна пара спаренных е- и два неспаренных е-.
— одна пара спаренных е- и два неспаренных е-.
Однако в атоме имеются АО с одинаковым запасом энергии, но расположенные на различных энергетических уровнях. Как их заполнять? Нам необходимо учитывать тот же принцип минимальной энергии.
Применяем правило Клечковского (1861 г.): вначале записывается та АО, тот подуровень, тот энергетический уровень, где сумма квантовых чисел n + l будет меньше в случае равных значений n + l, тот уровень, где n — меньше.
Пример: Элемент К расположен в IV периоде, открывает его. Однако в третьем периоде был только завершен подуровень р у Аr.
Что вначале будет заполняться?
3d? Или 4s?
3d: сумма n + l = 3 + 2 = 5.
4s: сумма n + l = 4 + 0 = 4.
4 < 5 ⇒ вначале заполняется 4s, а затем вновь рассуждаем: 4p? или 3d?
4р: сумма n + l — 4 + 1 = 5;
3d: сумма n + l = 3 + 2 = 5.
Значение сумм одинаково, но по принципу минимальной энергии Е при n = 3 меньше, чем Е при n = 4, следовательно будет заполняться 3d, а затем 4р.
Итак, следует помнить, что в атоме каждый электрон располагается так, чтобы его энергия была минимальной, что отвечает наибольшей связи его с ядром.
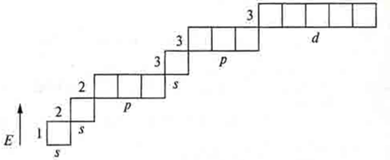
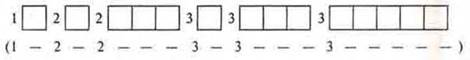
Следует знать, что существует формула распределения, где мы можем записать энергетические уровни и подуровни, которые открываются на энергетическом уровне:
![]()
Однако с учетом всех правил и принципов есть формула заполнения.
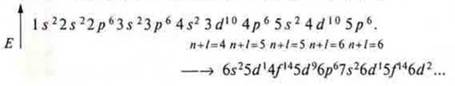
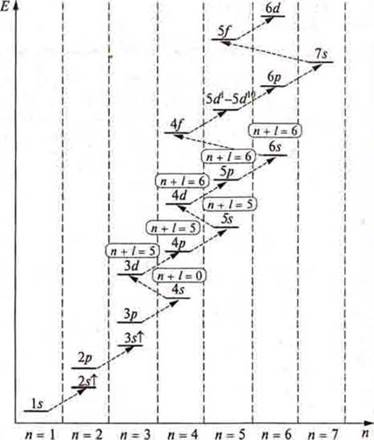
Расположение подуровней по энергии и порядок их заполнения электронами (показан стрелками)
Рассмотрим заполнение электронами атомов элементов малых периодов.
Пример:
а) элемент водород, Н; заряд ядра +1; электронов — 1.
n = 1; l = 0; ml = 0 (одна орбиталь)
s-подуровень ms = +1/2.
Электронная формула водорода:
Графическое изображение электронной формулы:
б) элемент гелий, Не; заряд ядра — +2; 2е- — два электрона.
n = 1; l = 0; ml = 0; ms = ±1/2.
электронная формула 1s2.
графическое изображение: ![]() спаренные электроны.
спаренные электроны.
У элементов второго периода согласно принципу минимальной энергии вначале заполнится первый энергетический уровень, а затем будет заполняться по принципу минимальной энергии, принципу Паули, правилу Хунда — второй энергетический уровень.
a) Li — литий; +3; 3е-.
n = 2; 1s22s1.
б) С — углерод; +6; 6е-; n = 2; 1s22s22p2.
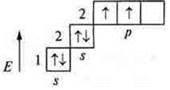
Далее учащиеся работают с табл. 2 учебника на с. 16—17 и делают выводы о незавершенном и завершенном энергетическом уровне.
У атома неона Ne: +10; 10е-; 1s22s22р6.
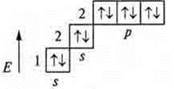
На втором энергетическом уровне максимальное количество е-
n = 2n2; n = 8.
Энергетический уровень завершен.
Элементы, у которых заполняется s-подуровень, называются s-элементами, p-подуровень — p-элементами.
У элементов третьего периода в атоме три энергетических уровня. Первый и второй энергетические уровни заполнены.
1s22s22p6 — это структура неона Ne, а на третьем энергетическом уровне открываются три подуровня 3s3p3d, т.к. при n = 3, l = 0, 1, 2.
От натрия до магния заполняется 3s до 3s2. Это s-элементы. От алюминия до аргона заполняется 3р до 3р6 — это p-элементы. Третий период заканчивается аргоном 1s22s22p63s23p6, у которого внешний энергетический уровень имеет октет электронов, он устойчивый.
Элемент четвертого периода в атоме имеет четыре энергетических уровня, т. к. n = 4.
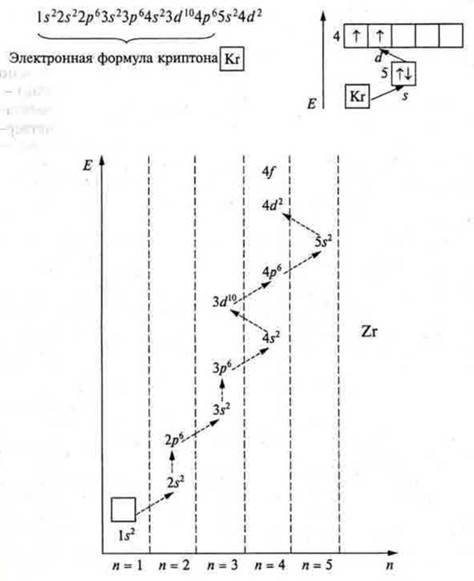
Согласно правилу Клечковского у К и Са заполняется 4s до 4s2 — это s-элементы. Далее, начиная со Sc и заканчивая Zn, согласно тому же правилу Клечковского будет заполняться 3dдо 3d10 (цинк) — это будут d-элементы. Четвертый период заканчивается р-элементами, начиная с галия и заканчивая криптоном, у которого на четвертом энергетическом уровне так же, как и у неона, аргона, — октет электронов, устойчивый энергетический уровень.
У элементов пятого периода идет заполнение 5s → 4d → 5р, шестого периода 6s → 5d1 → 4f → 5d10 → 6р.
4f— это лантаноиды;
f-элементы седьмого периода — 7s → 6d1 → 5f → 6d10 → 7p.
5f — это актиноиды, f-элементы.
Таким образом, в зависимости от того, какой заполняется подуровень (s-, р-, d-, f-), элементы делятся на семейства: s-элементы, р-элементы, d-элементы, f-элементы; s- и р-элементы располагаются в главных подгруппах:
s-элементы — в главных подгруппах I, И групп;
р-элементы — в главных подгруппах III—VIII групп;
d-элементы располагаются в побочных подгруппах;
f-элементы — это два семейства — лантаноиды и актиноиды.
Следует помнить, что для правильного дополнения АО необходимо применять принцип минимальной энергии, принципы Паули и Хунда, правило Клечковского.
Однако есть некоторые исключения для 10 элементов: Сu, Ag, Au, Cr, Md, Nb, Ru, Rh, Pd, Pt. В атомах данных элементов происходит самопроизвольный переход одного электрона (у Pt — двух) с s-подуровня внешнего энергетического уровня в d-подуровень предвнешнего энергетического уровня. Такое явление называется провалом электрона или проскоком.
Оно связано с выигрышем в энергии, с симметрией АО.
Атом считается симметричным, если большинство электронов либо спаренные, либо неспаренные.
III. Домашнее задание
§ 3 № 1, 2, 5, 6 (устно); № 3, 4, 7 — письменно.
IV. Закрепление
Задание: Составить электронную формулу и графическое изображение электронной формулы элемента № 40.
Ответ: цирконий, заряд ядра +40, в атоме 40 электронов, которые распределены по пяти энергетическим уровням, так как n = 5. Это d-элемент, так как расположен в побочной подгруппе.