Поурочные разработки по химии 11 класс
Дисперсные системы - ДИСПЕРСНЫЕ СИСТЕМЫ. РАСТВОРЫ. ПРОЦЕССЫ, ПРОИСХОДЯЩИЕ В РАСТВОРАХ - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: дать представление о дисперсных системах и их классификации; показать значение дисперсных систем в природе и жизни человека, относительность деления растворов на истинные и коллоидные.
Основные понятия: дисперсная система, грубодисперсная система, тонкодисперсная система; взвеси, эмульсия, суспензия, аэрозоль, коллоидная система; золь, гель, истинные растворы, эффект Тиндаля, дисперсионная среда, дисперсная фаза, чистое вещество, смесь, синерезис, мицелла.
Оборудование: препараты бытовой химии, аэрозоли; гели косметические, медицинские, пищевые; мази, пасты; чугун, сталь и изделия из них; образцы горных пород, минералы; вода, растительное масло (для демонстрации эмульсий); желатин, вода (для демонстрации желе); NaCl, бензол, одеколон, минеральная вода (для демонстрации относительности деления растворов на истинные и коллоидные: Na2SiO3, HCl, FeCl3, NH3 (р-ры); АlСl3(тв.); HCl, спирт.
Ход урока
I. Организационный момент
Урок изучения нового материала. Если в школе ведется научная работа, то на уроке возможна предварительная зашита реферата, темой которого являются вопросы, связанные с применением дисперсных систем в жизни человека, например по теме «Составляющие ингредиенты косметики и их влияние на живой организм». В другом случае возможна лекция с элементами беседы и демонстрацией опытов.
II. Изучение нового материала
План изложения
1. Понятие о дисперсной системе. Дисперсионная среда, дисперсная фаза.
2. Классификация дисперсных систем по признакам:
а) агрегатное состояние;
б) величина частиц дисперсной фазы и дисперсионной среды:
— грубодисперсные системы: эмульсии, суспензии (взвеси), аэрозоли (сообщения учащихся);
— тонкодисперсные: коллоидные растворы (золи, гели); истинные растворы (сообщения учащихся) — молекулярные, молекулярно-ионные, ионные;
в) степень взаимодействия между дисперсной фазой и дисперсионной средой.
3. Значение различных дисперсных систем в жизни человека и природы.
Состояние чистого вещества описывается так: твердое, жидкое, газообразное. Однако абсолютно чистых веществ в природе не существует. Даже незначительное количество примесей может существенно влиять на свойства вещества — температуру плавления, кипения, электро- и теплопроводимость, реакционную способность. Получение чистых веществ — важнейшая задача современной химии: только чистое вещество проявляет свои индивидуальные свойства качественно.
Существует следующая маркировка веществ:
|
Маркировка |
Степень чистоты |
Содержание примесей |
Области применения |
|
«Ч» |
Чистое |
2 · 10-5—1,0 · 10-5 % |
В промышленности |
|
«ЧДА» |
Чистое для анализа |
1,0 · 10-5—0,4 · 10-5 |
Для анализа технических продуктов |
|
«ХЧ» |
Химически чистое вещество |
5,0 · 10-6—0,0 · 10-6 |
В научно-исследовательских и лабораторных работах |
|
«ОСЧ» |
Особенно чистое вещество |
1,0 · 10-10—1,0 · 10-14 |
В электронике, полупроводниках |
Однако в природе, и в жизни человека встречаются не отдельные вещества, а их системы. Важнейшими из них являются дисперсные, т.е. гетерогенные системы — состоящие из двух или более фаз с сильно развитой поверхностью раздела между ними. Фаза— часть системы, отделенная от других ее частей поверхностью раздела.
Одна из фаз раздроблена на мелкие частицы и равномерно распределена в объеме другого вещества — это дисперсная фаза, а другая — сплошная фаза — дисперсионная среда.
В зависимости от сочетания агрегатного состояния дисперсной фазы и дисперсионной среды можно выделить 9 видов таких систем. Следует обратить внимание учащихся на таблицу № 9 с. 66 учебника.
В тетрадях учащиеся составляют таблицу:
Классификация дисперсных систем
|
Дисперсионная среда |
Дисперсная фаза |
||
|
газ |
жидкость |
твердое вещество |
|
|
Газ |
Воздух, природный газ |
Аэрозоль, туман, попутный нефтяной газ |
Аэрозоль (смог), дым, пыль |
|
Жидкость |
Шипучие напитки, пены, газовые эмульсии |
Эмульсии (плазма крови, лимфа, пищеварительный сок, цитоплазма) |
Строительные растворы, суспензии, золи (кисель, сель, клей, ил) |
|
Твердые в-ва |
Порошки, пористое тело, почва, текстильные ткани, наст снежный |
Медицинские и косметические средства (мазь, тушь, помада), влажная почва |
Минералы, сплавы, горные породы, цветное стекло |
Классификация дисперсных систем по величине частиц
|
Дисперсная система |
Размер частиц, м |
|
1) Тонкодисперсная система а) Истинные растворы б) Коллоидные системы (золь, гель) |
≤ 10-9 ≥ 10-9 ≤ 10-7 |
|
2) Грубодисперсная система (эмульсии, суспензии) |
≥ 10-7 |
Дисперсные системы классифицируются по степени взаимодействия дисперсной фазы с дисперсионной средой:
а) взаимодействие слабое: если среда водная — система гидрофобная — галогениды серебра; система лиофобнан, если среда не водная.
б) взаимодействие сильное: если среда водная — гидрофильные системы, они самопроизвольно образуются, имеют высокую дисперсность. Если среда не водная — то лиофильные системы, они термодинамически устойчивы и не разрушаются со временем.
Учитель показывает пример системы: белки, каучуки. Во время рассказа учителя учащиеся рассматривают образцы чугуна и стали.
Для дисперсных систем важен признак гетерогенности. Например, сплавы железа: чугун и стали — отличаются именно по этому признаку. Процентное содержание углерода в них разное. В чугуне более 0,02 %, а в стали менее 0,02 %.
Избыток углерода в чугуне становится твердым раствором, выделяется в виде пластинок графита. Вследствие этого чугун хрупок, в отличие от стали: сталь — это твердый гомогенный раствор углерода в железе. Сталь можно прокатывать, ковать, штамповать, волочить. На изломе чугуна можно заметить серый цвет графита. При затвердевании чугун не сжимается, как большинство металлов, а расширяется, как вода и лед. Используется чугун только для литья. Таким образом, чугун — дисперсная гетерогенная система.
Сталь — дисперсная гомогенная система. Это твердый, истинный раствор.
Учитель демонстрирует некоторые дисперсные системы:
грубодисперсные: размер частиц ≥ 100 нм. Это непрозрачные системы, частицы видны невооруженным глазом, отстаиваются, у жидкостей видна граница раздела;
а) эмульсии: синтомициновая эмульсия — лекарство; молоко; лимфа (природная), водоэмульсионная краска, битумный материал, строительные эмульсии.
На основе эмульсий получают полимеры: каучук, полистирол, поливинил, ацетат.
б) суспензии: дисперсная фаза твердая, нерастворимая в дисперсионной среде она жидкая.
Пример: «известковое молоко» — Са(ОН)2 и Н2О — строительный раствор; ил речной и морской; мел и Н2О (показать).
Суспензии чаше называют взвесями.
Грубодисперсные системы очень высокой дисперсной фазы называются пастами: зубные пасты (демонстрация — пасты, помады, тушь).
Коллоидные системы относятся к тонкодисперсным и имеют размер частиц от 100 до 1 нм. Коллоидная частица называется мицеллой. Она имеет довольно сложное строение, состоящее из частицы гранулы и диффузного слоя. Гранулы могут иметь и положительный, и отрицательный заряд. Это зависит от избытка одного из реагентов. В случае образования коллоидного раствора из AgNO3 и NaCl, при избытке AgNО3 гранула имеет положительный заряд, при избытке NaCl гранула отрицательно заряжена.
Далее идет сообщение учащихся (или рассказ учителя).
Коллоидные системы хорошо распространены в природе. Почва, глина, природные воды, воздух, облака, пыль, дым, многие минералы и даже драгоценные камни — это все коллоидные системы. Коллоидные системы имеют большое значение в биологии, медицине. Все пищевые продукты — хлеб, молоко, масло — коллоидные системы.
С химической точки зрения организм в целом — это сложнейшая совокупность многих коллоидных систем, включая жидкие коллоиды и гели. Кровь, плазма, лимфа, спинномозговая жидкость — системы, в которых белки, холестерин, гликоген и другие вещества находятся в коллоидном состоянии. А почему коллоидным состояниям природа отдает предпочтение? В коллоидном состоянии вещество имеет большую поверхность раздела между фазами, а это способствует лучшему протеканию важнейшего жизненного процесса — обмену веществ.
К примеру: если взять кубик вещества с ребром 10-2 м, его поверхность составляет 6 · 10-4 м2. Если раздробить вещество до размера коллоидной частицы 10-7—10-9 м, то суммарная площадь 1 м3 вещества уже составит сотни и тысячи квадратных метров. А скорость реакций, как известно, зависит от поверхности соприкосновения.
Коллоидные системы подразделяются на золи и гели.
Золи — коллоидные растворы с изолированными друг от друга частицами фазы и дисперсионной средой.
Пример: кремниевая кислота, растворимое стекло Na2SiО3
Демонстрация эксперимента:
а) ![]()
б) гидролиз АlСl3 в горячей воде дает золь.
Гели — коллоидная система с соприкасающимися частицами фазы и дисперсионной среды. Это студенистые тела. Частицы дисперсной фазы соединяются между собой в рыхлую пространственную сетку, в ячейках которой содержится дисперсионная фаза (среда). Эта система лишена текучести.
Далее на кодотранспоранте рассматриваются примеры гелей.
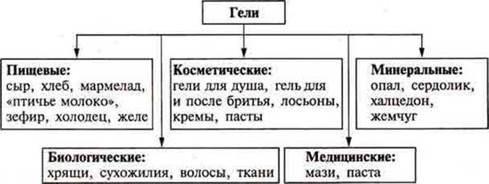
Демонстрация: желатин + Н2O, крахмальный клейстер.
Для гелей характерна реакция синерезиса — самопроизвольного выделения жидкости. Уплотняется структура геля, уменьшается объем. Явление синерезиса определяет срок годности продукта: пищевого, косметического, медицинского. Свертывание крови — это тоже сииерезис. Идет превращение растворимого белка крови — фибриногена — в нерастворимый — фибрин. Это защитная реакция организма.
Золи могут подвергаться коагуляции. Это объединение коллоидных частиц в более крупные агрегаты и выпадение их в осадок под влиянием температуры, изменения концентрации, механического воздействия, облучения, добавления электролита, образование геля.
Внешне коллоидные растворы бывают полупрозрачными и прозрачными растворами. Их можно не отличить от тонкодисперсных систем — истинных растворов, где размеры частиц фазы ≤ 1 нм. Для коллоидных растворов характерен эффект Тиндаля.
При пропускании луча света через коллоидный раствор крупные частицы отражают свет от своей поверхности, в сосуде виден светящийся конус. Такого конуса не наблюдается при пропускании луча света через истинный раствор, тонкодисперсную систему.
Как правило, коллоидные растворы — гомогенные системы, состоящие из двух и более веществ одной фазы. Одно вещество распределено в другом в виде атомов, молекул, ионов. Растворитель, дисперсионная среда, агрегатное состояние не изменяется при образовании дисперсной системы.
Пример: растворитель — дисперсионная среда вода; в водных растворах солей, кислот, щелочей, сахара, углекислого газа.
Воздух — это раствор кислорода, азота, благородных газов, углекислого газа.
Столовый уксус 9 % — вода растворитель.
Уксусная эссенция 80 % — растворитель уксусная кислота.
Растворы подразделяются на:
— молекулярные — водные растворы неэлектролитов (спиртовой раствор йода, растворы сахарозы, глюкозы);
— молекулярно-ионные — растворы слабых электролитов (азотистая кислота, угольная кислота, аммиачная вода);
— ионные растворы — растворы электролитов.
Следует считать, что растворение — физико-химический процесс, т.к. наряду с образованием обычной механической смеси веществ идет и процесс взаимодействия частиц растворенного вещества с растворителями. К таким заключениям в 1887 году пришел Д. И. Менделеев. Точное определение раствора: раствор — гомогенная (однородная) система, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия.
Эксперимент.

Идет гидратация катиона меди (II) молекулами воды. Гидратированные ионы придают раствору голубой цвет, выделяется тепло — признак химической реакции.
II. Обобщение и выводы
Итак, на данном уроке мы изучили более углубленно классификацию дисперсных систем, важность их в природе, жизни человека.
Однако следует отметить, что резкой границы между видами дисперсных систем нет. Классификацию считать относительной.
В зависимости от условий одна система может перейти в другую.
Пример: кровь — коллоидный раствор и может стать грубодисперсной системой. FeCl3 — тонкодисперсная система, но при нагревании образуется коллоидный раствор.
III. Домашнее задание:
§ 8. Записи в тетради. Определение. Вопросы § 8 устно.