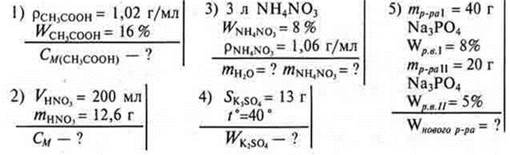Поурочные разработки по химии 11 класс
Растворение. Растворимость. Количественная характеристика растворов - ДИСПЕРСНЫЕ СИСТЕМЫ. РАСТВОРЫ. ПРОЦЕССЫ, ПРОИСХОДЯЩИЕ В РАСТВОРАХ - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: уточнить смысл понятия «растворимость» и выяснить, чем оно отличается от понятия «массовая доля растворенного вещества»; рассказать о способах выражения концентрации веществ; научить применять знание понятий «растворимость», «концентрации растворов» при решении расчетных задач.
Основные понятия: растворимость, коэффициент растворимости, насыщенный раствор, ненасыщенный раствор, массовая доля растворенного вещества, процентная концентрация, молярная концентрация, объемная доля, мольная доля.
Оборудование: CuSO4 (безводный), CuSO4 · 5H2O; Н2O, термометр, посуда.
Ход урока
I. Беседа с учащимися по узловым вопросам.
1. Дать определение дисперсной системы, дисперсной фазы, дисперсионной среды.
2. Назвать признаки классификации дисперсных систем; привести примеры.
3. Какое значение дисперсные системы имеют в природе и в быту?
4. Дать определение раствора, растворителя. Какие известны виды растворов?
5. Растворение — это физический или физико-химический процесс? Обосновать на основании эксперимента взаимодействие безводного сульфата меди (II) с водой.
В ходе беседы с учащимися идет закрепление теоретических знаний вопроса о дисперсных системах. Учащиеся находят ответы на вопросы в своих конспектах, учебниках.
В ходе обсуждения последнего вопроса проводится эксперимент, доказывающий, что растворение есть физико-химический процесс.
Наряду с равномерным распределением частиц дисперсной фазы между частицами дисперсионной среды происходит физический процесс, диффузия. Между ними наблюдается взаимодействие, что доказывает выделение теплоты и изменение цвета, а это признаки химической реакции.
![]()
В растворе присутствуют не только частицы растворенного вещества, частицы растворителя, но и продукт их взаимодействия — гидратированные катионы меди (II), придающие раствору голубой цвет. Следует отметить, что происходит образование ковалентной связи по донорно-акцепторному механизму между катионом меди (II) и молекулами воды, вследствие чего и выделяется тепло.
II. Изучение нового материала
План изложения
1. Растворимость. Коэффициент растворимости. Таблица растворимости солей, щелочей, кислот в воде.
2. Растворы насыщенные, ненасыщенные.
3. Количественные характеристики состава раствора:
а) молярная концентрация раствора;
б) массовая доля растворенного вещества — процентная концентрация раствора;
в) объемная и мольная доли растворенного вещества.
4. Алгоритм решения расчетных задач на количественную характеристику растворов.
Что же такое растворимость веществ? Это способность веществ разрушаться до структурных единиц под действием растворителя. Растворимость зависит от природы растворяемого вещества, природы растворителя, температуры, давления для газов. По растворимости вещества делят на хорошо растворимые (растворяется более 1 г в 100 г растворителя), малорастворимые (растворяется от 0,01 г до 1 г в 100 г растворителя) и практически нерастворимые вещества (растворяется менее 0,01 г в 100 г растворителя при температуре 25°С). Sвещ. t°— растворимость вещества при определенной температуре.
Однако при другой температуре растворимость вещества иная. Поэтому применяется коэффициент растворимости. Он показывает, сколько грамм вещества может растворяться в 100 г растворителя при данной температуре.
Пример: При t° = 30 °С в 100 г растворителя растворяется CuSO4 30 г, а при t° = 70 °С — 50 г CuSO4 (последняя справочная литература предлагает определение растворимости на 1000 г растворителя).
Растворы бывают ненасыщенные и насыщенные. Насыщенный раствор содержит максимальное количество растворенного вещества при данной t°. Ненасыщенный раствор содержит при данной t° меньше растворенного вещества, чем может раствориться.
Для выражения состава раствора используют количественные характеристики растворов или концентрации — молярная концентрация раствора; массовая доля растворенного вещества или процентная концентрация.
Молярная концентрация вещества показывает количество моль вещества в 1 л раствора:
![]()
Массовая доля растворенного вещества показывает количество растворенного вещества в 100 г раствора:
![]() (процентная концентрация).
(процентная концентрация).
Если в системе газы, то применяется объемная доля — φ:
![]()
Иногда необходимо рассчитать мольную долю растворенного вещества.
![]()
Далее учащимся предлагаются расчетные задачи на количественную характеристику растворов.
III. Решение расчетных задач на количественную характеристику растворов
Следует помнить некоторые рекомендации при решении задач:
а) если в условии задачи известны V (мл) — объем, ρ (г/мл) — плотность и Wp.н., следует вначале определить через плотность и объем массу раствора: mр-ра = ρ · V и ввести в формулу массовой доли растворенного вещества:
![]()
б) если требуется определить массовую долю растворенного газообразного вещества, следует определить через объем количество вещества, а затем его массу:
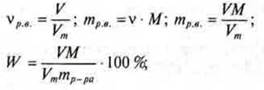
в) определение массовой доли растворенного вещества, если известна растворимость:
![]()
Задачи с понятием «растворимость»
№ 1. Растворимость бромида натрия при 20 °С равна 905 г. Какую массу соли можно растворить в воде массой 900 г при 20 °С?
Дано:
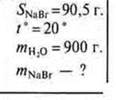
I способ
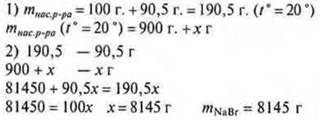
II способ
в 100 г воды при 20° растворяется 90,5 г
а в 900 г воды —”— х г
![]()
Ответ: можно растворить 814,5 г NaBr.
№ 2. В какой массе воды надо растворить нитрат калия массой 165 г, чтобы получить насыщенный раствор при t° = 35 °С? SKNO3 = 75 г; t° = 35 °С (в 100 г воды при t° = 35 ° растворяется 75 г).
Дано:
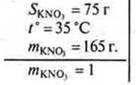
I способ
В 100 г воды при 35 ° растворяется 75 г
В х г воды при 35 ° —”— 165 г
Х = 220 г воды
II способ
mнасыщенного раствора = 100 г + 75 г = 175 г
175 г — 75 г соли
Хнас. р-ра г — 165 г соли
х = 385 г — масса насыщенного раствора.
![]()
Ответ: mH2О = 220 г.
Задачи на состав раствора с массовой долей растворенного вещества
№ 1. Вычислить массу йода и спирта, необходимых для приготовления раствора массой 300 г, Wp.в. = 10%.
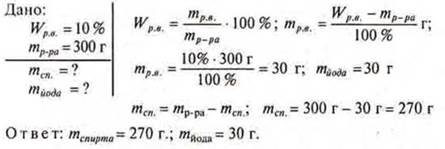
Задачи на определение молярной концентрации раствора
Раствор объемом 500 мл содержит гидроксида натрия 8 г. Определить молярную концентрацию раствора.
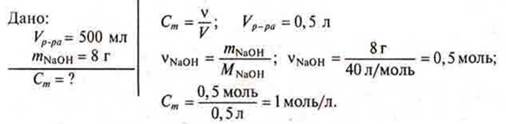
Задачи на переход от одного выражения концентрации раствора в другой
При решении таких задач следует помнить, что масса растворенного вещества одинакова. Вначале следует выразить массу растворенного вещества по каждому виду концентрации, а затем приравнять эти выражения.
Пример: нам известна массовая доля растворенного вещества W. Необходимо перевести эту концентрацию в молярную СМ.
1) Записываем формулы выражения данных концентраций и выражаем в обоих случаях массу растворенного вещества:
![]() СМ - молярная концентрация раствора.
СМ - молярная концентрация раствора.
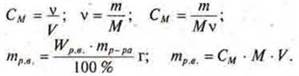
2) Так как масса растворенного вещества в обоих случаях одинакова, записываем:
![]()
3) Выражаем молярную концентрацию вещества
![]()
Задача. Найти молярную концентрацию раствора хлороводородной кислоты ρ = 1,19 г/мл с WHCl = 36%.
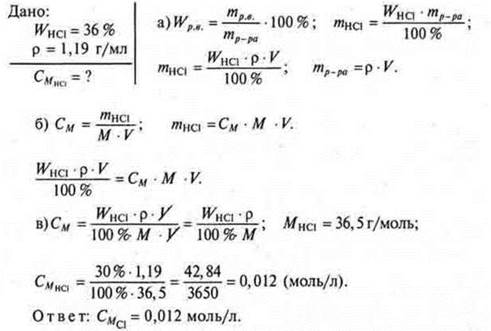
Решение задач в случае разбавления, смешивания, концентрирования растворов
№ 1. К 250 г раствора глюкозы W = 10% прилили 150 мл воды. Какова W глюкозы в новом растворе?
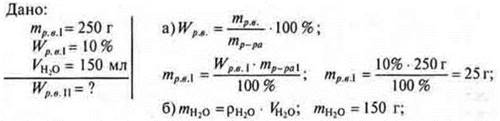
в) Так как изменилась только mр-ра, mглюкозы осталась неизменной.
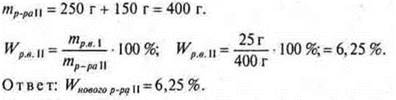
№ 2. Какую массу соли необходимо добавить к раствору соли массой 300 г, Wр.в. = 20%, чтобы получить раствор Wр.в. = 40%?
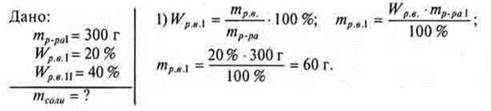
2) Пусть масса соли, которую необходимо добавить, x г.
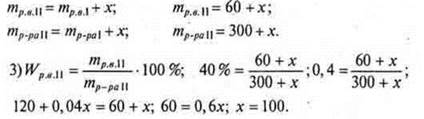
Ответ: следует добавить 100 г соли.
IV. Домашнее задание
§ 8, записи.
Решить задачи согласно условиям: