Поурочные разработки по химии 11 класс
Водородный показатель - ДИСПЕРСНЫЕ СИСТЕМЫ. РАСТВОРЫ. ПРОЦЕССЫ, ПРОИСХОДЯЩИЕ В РАСТВОРАХ - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: дать понятие «водородный показатель»; дать представление об ионном произведении воды, константе диссоциации воды, научить применять понятие «водородный показатель» для характеристики среды растворов электролитов и для экспериментального определения среды.
Основные понятия: водородный показатель — pH, ионное произведение воды, кислая, нейтральная, щелочная среды, индикаторы.
Оборудование: индикаторы (метилоранж, фенолфталеин, синий лакмус, универсальный индикатор), растворы кислот, щелочей, вода; раствор мыла (хозяйственного, туалетного), желудочный сок, шампунь, электролиты № 1, 2, 3, пробирки.
Ход урока
I. Организационный момент
Урок комбинированный. В момент опроса — тестовые задания. В момент изучения нового материала — рассказ учителя.
II. Обсуждение тестовых заданий
Учащиеся сдают домашнюю работу по вариантам.
По материалу прошедшего урока выполняются, а потом обсуждаются тестовые задания.
1. Выберите ряд, в котором перечислены ионы: а) способные одновременно существовать в водном растворе:
![]()
б) неспособные одновременно существовать в водном растворе:
![]()
2. Хлорид магния реагирует с каждым из двух веществ:
а) H2S и NaOH;
б) КОН и AgNO3;
в) СО и NaCl;
г) ВаСl2 и Н2СO3.
3. Сокращенному ионному уравнению ![]() соответствует молекулярное уравнение:
соответствует молекулярное уравнение:
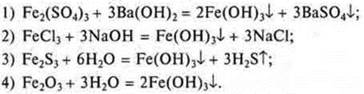
4. Установите соответствие между сокращенными ионными уравнениями и типом реакции ионного обмена.
Сокращенное ионное уравнение:
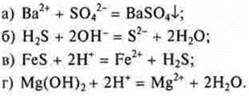
Реакция ионного обмена:
A) Сильная кислота + слабое основание = соль + вода.
Б) Соль + сильная кислота = соль + слабая кислота.
B) Слабая кислота + сильное основание = соль + Н2O.
Г) Соль + сильное основание = соль + слабое основание.
Д) Соль + соль = соль + соль.
Е) Сильная кислота + сильное основание = соль + вода.
5. Сумма коэффициентов в уравнении электролитической диссоциации Rb2Sr2(SO4)3 =
6. Сумма коэффициентов в кратком ионном уравнении реакции между гидроксидом хрома(Ш) и соляной кислотой.
7. Сумма коэффициентов в полном ионном уравнении реакции между гидроксидом железа(II) и серной кислотой.
8. Укажите пару веществ, которые могут одновременно находиться в одном растворе, не вступая в реакцию друг с другом:
![]()
II. Изучение нового материала
План изложения
1. Вода — слабый электролит. Диссоциация воды. Константа воды. Ионное произведение воды.
2. а) водородный показатель;
б) среда кислая, щелочная, нейтральная.
3. Качественное определение типа среды. Индикаторы и их реакция на различный тип среды.
4. Характеристика среды в живом организме с использованием водородного показателя.
Вода — очень слабый электролит.
Уравнение диссоциации воды следующее:
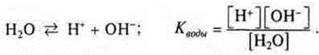
Так как диссоциирует ничтожно малое количество молекул воды, то величина равновесной концентрации воды [Н2O] очень мала, ей можно пренебречь.
![]()
Произведение концентрации катионов водорода и гидроксид-ионов называется ионным произведением воды; при t = 25 °С Кв= 10-14. Эта величина постоянная. Ионное произведение воды дает возможность вычислить концентрации гидроксид-ионов, если известны концентрации катионов водорода и наоборот.
Пример.
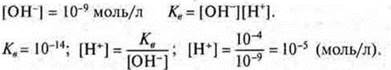
По концентрации ионов водорода гидроксид-анионов различают типы сред:
нейтральная среда — [H+] = [ОН-] = 10-7;
кислотная среда — [Н+] > [ОН-] > 10-7;
щелочная среда — [Н+] < [ОН-] < 10-7.
Однако для характеристики сред больше применимо понятие «водородный показатель», pH (пэ-аш), введенное датским химиком Серенсеном. р — от начального слова potent — математическая степень, буква Н — химический знак водорода. pH — водородный показатель называется отрицательным десятичным логарифмом концентрации катионов водорода.
pH = -lg [H+], если [Н+] = 10-8, pH = -lg10-8= 8,
если [Н+] = 10-3; то pH = 3.
Для удобства определения среды по pH используют схему зависимости между концентрацией катионов водорода, значением pH и реакцией среды.
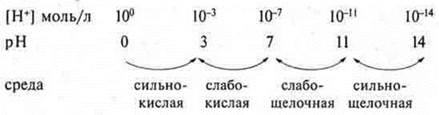
pH = 7 — среда нейтральная;
pH < 7 — кислая среда;
pH > 7 — щелочная среда.
Для качественного определения типа среды, pH водного раствора электролита применяют индикаторы.
Индикаторы — вещества, изменяющие свой цвет в зависимости от среды раствора.
Эксперимент:
Определить реакцию среды электролита в растворах № 1, 2, 3, применяя индикаторы: а) универсальные; б) метилоранж; в) фенолфталеин; г) синий лакмус.
Составление таблицы учащимися на основании лабораторного опыта.
|
Индикатор |
№ 1 |
№ 2 |
№ 3 |
|
Универсальный |
зеленый pH = 7 нейтральный |
розовый pH < 7 кислая |
синий pH > 7 щелочная |
|
Фенолфталеин |
— |
— |
малиновый |
|
Метилоранж |
оранжевый |
розово-красный |
желтый |
|
Синий лакмус |
фиолетовый |
красный |
синий |
Учитель проводит эксперимент определения среды: раствор мыла, шампунь, гель, жидкое мыло, желудочный сок.
Таким образом, зная pH электролита, можно определить тип среды и объяснить многие процессы протекающих химических реакций с определенной скоростью и направлением в зависимости от среды. Изменяется и скорость, и направление ее протекания.
В живом организме pH не одинакова как на клеточном уровне, так и в межклеточном пространстве: кровь, лимфа, слюна, желудочный сок.
рНкрови = 7,4 — слабощелочная среда;
рНслюны = 7 — близкая к нейтральной;
pHжелудочного сока = 1,7 — сильнощелочная.
Ог pH зависит и работа фермента-катализатора. Фермент крови каталаза работает при pH = 7, фермент желудочного сока пепсин работает при pH = 1,5—2. Все это важно знать при медицинской диагностике.
Знание понятия водородного показателя в курсе химии необходимо при определении среды, особенно среды растворов солей. Это материал для изучения на следующем уроке.
III. Домашнее задание
§ 15, с. 151 — 153 (записи), с. 156, № 7.