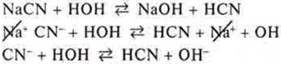Поурочные разработки по химии 11 класс
Урок-лекция по теме «Гидролиз неорганических веществ — солей» - ДИСПЕРСНЫЕ СИСТЕМЫ. РАСТВОРЫ. ПРОЦЕССЫ, ПРОИСХОДЯЩИЕ В РАСТВОРАХ - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: сформировать представление о гидролизе, сущности гидролиза солей; научить составлять уравнения реакций гидролиза солей в молекулярном и ионном виде, определять реакцию и тип среды раствора электролита на основании состава соли.
Основные понятия: гидролиз, гидролиз по катиону, гидролиз по аниону, молекулярный вид уравнения гидролиза, общий ионный и краткий ионный виды уравнения, реакция среды.
Оборудование: Н2O (дистил.), АlСl3 (кр.), Na2СO3 (тв.), NaCl, CuCl2, универсальные индикаторы, спиртовки, пробирки, держатели.
Ход урока
I. Организационный момент
Постановка целей и задач урока. При изучении темы «Гидролиз» очень важны знания понятий «водородный показатель», «типы среды шектролита».
План изложения
1. Эксперимент. Определение реакции среды растворов солей универсальным индикатором.
2. Понятие «гидролиз солей». Алгоритм составления уравнения гидролиза солей:
а) по катиону;
б) по аниону.
Условия усиления и ослабления гидролиза.
3. Гидролиз солей, образованных слабой кислотой и слабым основанием.
4. Значение гидролиза солей в живом организме, в природе, в быту.
II. Изучение нового материала
Эксперимент:
Определение реакции среды электролитов — растворов солей универсальным индикатором.
АlСl3 розовый цвет pH < 7 среда кислая
Na2CO3 синий цвет pH > 7 среда щелочная
NaCl зеленый цвет pH = 7 среда нейтральная
Необходимо научно обосновать происходящие явления.
Гидролиз — взаимодействие соли с водой, в результате которого идет образование слабого электролита. Если кислота — кислая соль, если основание — основная соль, и происходит изменение среды раствора. Гидролиз — процесс обратимый. Гидролизу подвергаются растворимые соли, в состав которых входит либо катион слабого электролита, либо анион слабого электролита. Если катион слабого электролита — идет гидролиз по катиону. Если анион слабого электролита — идет гидролиз по аниону. Если катион и анион многозарядные — гидролиз идет ступенчато. Если в состав соли входят катион и анион слабых электролитов, идет необратимый гидролиз. Гидролизу не подвергаются соли, образованные катионами и анионами сильных электролитов, а также нерастворимые в воде соли.
Пример:
В эксперименте были соли:
АlСl3 — соль образована слабым электролитом — основанием Аl(ОН)3, сильной кислотой — соляной, гидролизуется по катиону.
Na2CO3 — соль образована сильным основанием NaOH и слабой кислотой Н2СO3 — угольной, гидролизуется по аниону.
NaCl — соль образована сильным основанием NaOH и сильной кислотой НСl, гидролиза нет.
Алгоритм составления уравнения гидролиза соли:
1. Составить уравнение диссоциации соли, определить ион слабого электролита.
2. Составить уравнение его взаимодействия с водой, определить продукты гидролиза в виде ионов.
3. Сделать вывод о среде электролита.
4. Составить уравнение в молекулярном и ионном виде.
![]()
Al3+ — катион алюминия, слабое основание гидролиза по катиону
![]()
среда кислая, т. к. [Н+] > [ОН-]
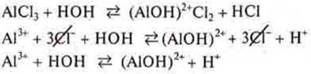
Другой вариант алгоритма составления уравнения гидролиза соли:
а) по химической формуле соли определить, какой кислотой и каким основанием образована соль;
б) записать левую часть уравнения в молекулярном виде;
в) составить уравнение в общем ионном виде, предположим, согласно этому уравнению, продукты правой части уравнения в молекулярном виде;
г) сократить одинаковые ионы в левой и правой частях уравнения общего ионного вида;
д) составить уравнение гидролиза в кратком виде, определить среду.
а) Na2CO3 — соль образована NaOH — сильное основание, Н2СO3 — слабая кислота, гидролиз по аниону СO32-;
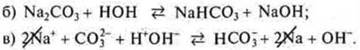
Предполагаем продукты правой части уравнения: соль NaHCO3 и основание NaOH; записываем в правую часть молекулярного уравнения;
г) составляем краткое ионное уравнение гидролиза, сокращаем катионы натрия:
![]()
Вывод: [ОН-] > [Н+] — среда щелочная; pH > 7.
Сделаем общий вывод проведенного в начале урока эксперимента: соли подверглись гидролизу, вследствие чего раствор вызвал определенную реакцию среды.
Если следует дать ответ быстро, не составляя уравнения гидролиза соли, следует помнить: «сильное пересиливает слабое». Определить, какими по силе электролитами образована соль, если сильным основанием — щелочная реакция среды: Кд осн > Кд кис, если сильной кислотой — среда кислая: Кд кисл > Кд осн, если и основание, и кислота сильные — реакция среды нейтральная: Кд кисл = Кд осн.
Пример. Какую реакцию среды имеют растворы солей CuSO4, KNO2, Na2SO4?
CuSO4 — реакция среды кислая, т. к. соль образована сильной кислотой — серной.
KNO2 — реакция среды щелочная, т. к. соль образована сильным основанием.
Na2SO4 — реакция среды нейтральная, т. к. соль образована сильной кислотой и сильным основанием.
Если соль образована многозарядным ионом, то гидролиз идет ступенчато.
Пример:
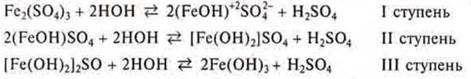
Почему при гидролизе соли не наблюдается выпадение осадка, т. е. не доходит гидролиз до III ступени? Так как гидролиз — процесс обратимый, то как только начинает возрастать концентрация катионов водорода, то по принципу Лe Шателье равновесие смещается в сторону обратной реакции, в сторону исходных продуктов.
Если требуется усилить гидролиз, то можно повысить t°, увеличить концентрации исходных продуктов или добавить в раствор кислоту, катионов водорода. Гидролиз будет подавлен.
Чтобы усилить гидролиз соли, следует добавить в раствор соединение, связывающее катион водорода, т.е. добавить раствор щелочи. Наблюдается образование воды Н+ + ОН- = Н2O, вследствие чего концентрация катионов водорода уменьшается и равновесие смещается в сторону прямой реакции. Гидролиз усиливается. Можно юбавить раствор соли, который имеет щелочную реакцию среды.
В случае гидролиза соли, образованной слабой кислотой, слабым основанием, образуются конечные продукты — слабое основание, слабая кислота. Гидролиз необратимый.
![]()
Какая реакция среды при таком гидролизе возможна? Среда определяется сравнением Кд слабых электролитов. Среда определяется большим значением Кд.
Пример. ![]()
![]()
В данном случае реакция среды будет нейтральной, т. к. Кд реагентов равны.
В таблице растворимости солей, кислот, оснований в воде в примечании указано «в водной среде разлагаются», т. е. подвергаются гидролизу.
III. Обобщение и выводы
1. Гидролиз — взаимодействие соли с водой с образованием слабого электролита и изменением реакции среды.
2. Гидролиз — обратимый процесс.
3. Возможен гидролиз: а) по катиону; б) по аниону.
4. Реакция среды зависит от соотношения Кд электролитов, образовавших соль.
5. Гидролиз необратим в том случае, если хотя бы один из продуктов гидролиза уходит из сферы реакции. Он сразу идет и по катиону, и по аниону.
Гидролиз имеет большое значение в живом организме, живой природе, в практической жизни человека.
В качестве моющего средства в древности использовали золу, в состав которой входит К2СО3 — карбонат калия, в воде гидролизуется с образованием щелочной реакции. Раствор становится мыльным. В настоящее время в быту используют мыло, моющие стиральные порошки — натриевые, калиевые соли высших жирных карбоновых кислот — стеариновой и пальмитиновой.
Гидролизуясь в водном растворе они дают щелочную реакцию:
![]()
В состав моющих средств входят соли неорганических кислот: фосфат, карбонат, они усиливают моющее действие.
В фотографическом деле соли — бура Na2B2О4, Na2CО3, К2СО3, гидролизуясь, создают щелочную реакцию.
При недостатке кислотности почвы у растений развивается заболевание хлороз. В почву вводится удобрение (NH4)2SО4, которое повышает кислотность почвы благодаря гидролизу по катиону:
![]()
Благодаря солям, входящим в состав крови — NaHCО3, NО2, НРО4, поддерживается определенная реакция среды. Они регулируют избыток Н+ и избыток ОН-. При избытке Н+ они связываются с ОН- и равновесие смещается вправо, усиливается гидролиз.
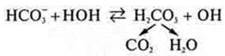
При избытке ОН- равновесие будет смешаться влево. Благодаря этому pH крови колеблется незначительно.
В полости рта поддерживается определенная среда. Благодаря аниону НPO42-, входящему в состав слюны, pH колеблется от 7 до 7,5.
IV. Домашнее задание
§ 16, с. 163-173, № 1, 3, 4, 5, 6.
Самостоятельно разобрать гидролиз других неорганических соединений — с. 173—174 (конспект в тетради).
Повторить сложные эфиры, белки, углеводы.
Закрепление
Выполнить № 6 § 16 с. 174.
|
|
KI |
AlCl3 |
K2SO3 |
(NH4)2SO4 |
NaCN |
|
Среда |
pH = 7 нейт. |
pH < 7 кисл. |
pH > 7 щел. |
pH < 7 кисл. |
pH > 7 щел. |
|
Сила эл-та |
Сильн. осн. Сильн. кисл. |
Слаб. осн. Сильн. кисл. |
Сильн. осн. Слаб. кисл. |
Слаб. осн. Сильн. кисл. |
Сильн. осн. Силь. осн. |
|
Фенолфт-н |
- |
- |
Малинов. |
- |
Малин. |