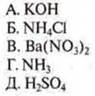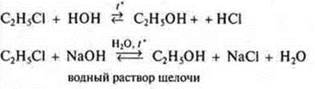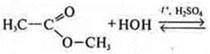Поурочные разработки по химии 11 класс
Гидролиз органических веществ - ДИСПЕРСНЫЕ СИСТЕМЫ. РАСТВОРЫ. ПРОЦЕССЫ, ПРОИСХОДЯЩИЕ В РАСТВОРАХ - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: обобщить сведения о гидролизе органических веществ; на основании понятия «гидролиз» показать единство мира органических и неорганических веществ; расширить представление о значении гидролиза органических веществ в живой природе и жизни общества.
Основные понятия: гидролиз, сложные эфиры, углеводы, белки-биополимеры, аденозинтрифосфорная кислота, аминокислоты.
Оборудование для эксперимента: в пробирках № 1, 2, 3 — растворы солей Na2SО3, ZnCl2, NaNО3; индикаторы: универсальный индикатор, фенолфталеин, синий лакмус, метилоранж.
Ход урока
I. Организационный момент
Урок комбинированный. На уроке предусмотрен опрос, эксперимент учащихся в момент монологического ответа. При изучении нового материала предусмотрена работа с учебником, составление таблицы в тетради.
II. Проверка знаний учащихся
1. Монологический ответ учащихся у доски с выполнением эксперимента. Определить реакцию среды растворов солей Na2SО3; XnCl2; NaNО3 индикаторами. Дать обоснованный ответ.
2. Домашнее задание № 3 (две соли).
3. Домашнее задание № 4 (две соли).
Все остальные учащиеся обсуждают выполнение задания № 5.
По окончании проверки домашнего задания предложить учащимся вопрос теста ЕГЭ:
1) Водные растворы какой пары солей имеют одинаковую реакцию (кислотную, щелочную, нейтральную)?
![]()
2) Установите соответствие между растворенным веществом и pH раствора:
|
1. Слабо щелочная |
|
|
2. Сильно кислотная |
|
|
3. Нейтральная |
|
|
4. Слабо кислотная |
|
|
5. Сильно щелочная |
Ответы на вопросы проверки знаний
Задание № 1. Эксперимент. Оформление в виде таблицы.
|
|
Na2SO3 |
ZnCl2 |
NaNO3 |
|
Кислота |
Слаб, к-та |
Силь. к-та |
Силь. к-та |
|
Основание |
Сильн. осн-е |
Слаб. осн-е |
Сильн. осн-е |
|
Сравнить Кд |
Кд кисл < Кд осн |
Кд кисл > Кд осн |
Кд кисл = Кд осн |
|
pH |
pH > 7 |
pH < 7 |
pH = 7 |
|
Среда |
Сильнощелочн. |
Кислотная |
Нейтральная |
|
Универсальный индикатор |
Синий |
Розовый |
Зеленый |
|
Фенолфталеин |
Малиновый |
- |
— |
|
Синий лакмус |
Синий |
Красный |
Фиолетовый |
|
Метилоранж |
Желтый |
Розово-красный |
Оранжевый |
Учитель анализирует правильность выполнения и оформления эксперимента, предупреждает, что на следующем уроке будет практическая работа по теме «Гидролиз. Реакции ионного обмена».
Задание № 2. Гидролизу по катиону подвергаются соли, образованные слабым основанием, сильной кислотой. Из предложенных солей это Cu(NO3)2, NH4NO3, NiSO4:
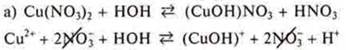
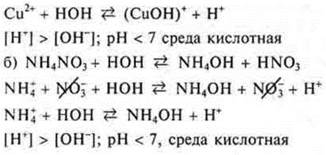
Задание № 3. Гидролизу по аниону подвергаются соли, образованные сильным основанием, слабой кислотой. Из предложенных солей это — Na2SО3, К(НСОО):
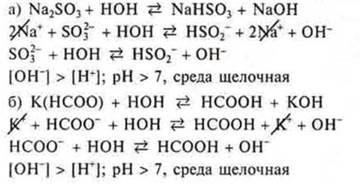
Задание № 4
|
|
SrCl2 |
Rb2SiO3 |
Соl2 |
ВаВr2 |
Fe(NO3)2 |
АlВr3 |
Li2CO3 |
Nal |
KNO3 |
|
К-та |
Сильн. |
Слаб. |
Сильн. |
Сильн. |
Сильн. |
Сильн. |
Слаб. |
Сильн. |
Сильн. |
|
Осн-е |
Сильн. |
Сильн. |
Слаб. |
Сильн. |
Слаб. |
Слаб. |
Сильн. |
Сильн. |
Сильн. |
|
pH |
7 |
> 7 |
< 7 |
7 |
< 7 |
< 7 |
> 7 |
7 |
7 |
|
Среда |
Нейтр. |
Щелоч. |
Кисл. |
Нейтр. |
Кисл. |
Кисл. |
Щелоч. |
Нейтр. |
Нейтр. |
|
Син. лакмус |
Фиол. |
Син. |
Красн. |
Фиол. |
Красн. |
Красн. |
Фиол. |
Фиол. |
Фиол. |

Соли, образованные сильными основаниями и сильными кислотами, не подвергаются гидролизу. Среда в этих растворах нейтральная.
Задания тестов ЕГЭ
1. Водные растворы веществ пары № 1 имеют нейтральную реакцию растворов, т. к. сами образованы сильным основанием и сильной кислотой. Гидролиза нет. KNO3 (КОН, HNO3), NaCl(NaOH, HCl). Если рассмотреть пары:
№ 2. Na2CO3, FeCl3, то в растворе:
Na2CO3 — щелочная среда,
FeCl3 — кислотная среда.
№ 3. Na2SO4, Cu(NO3)2:
Na2SO4 — нейтральная среда,
Cu(NO3)2 — кислотная среда.
№ 4. ВаВr2, АlВr3:
ВаВr2 — нейтральная среда,
АlВr3 — кислотная среда.
2. Слабо щелочная — раствор NH3; 1—Г;
Сильно кислотная — раствор H2SO4; 2—Д;
Нейтральная — раствор Ba(NO3)2; 3—В;
Слабо-кислотная — раствор NH4Cl; 4—Б;
Сильно щелочная — раствор КОН; 5—А.
III. Изучение нового материала
Работа учащихся с текстом § 16 с. 158—161 и заполнение таблицы «Гидролиз органических соединений и его практическое значение».
Таким образом, гидролиз характерен и для большинства органических веществ — это их важнейшее органическое свойство. Однако в этих случаях вода — реагент, и не обязательно один из продуктов — слабый электролит, как при гидролизе неорганических веществ, и не всегда изменяется среда раствора.
Гидролиз органических веществ также процесс обратимый, возможно наступление химического равновесия, и необходимо знать условия его смещения по принципу Ле Шателье.
Следует помнить, что изучение теоретических основ гидролиза требует знаний не только ранее изученных вопросов курса химии, но и вопросов курса биологии, особенно обмен веществ в живом организме.
IV. Домашнее задание
§ 16, подготовка к практической работе, повторение § 15, № 7, 8, 11, 12.
|
Органические соединения |
Уравнение гидролиза |
Практическое применение |
|
Галогеналканы |
|
Получение спирта. Присутствие щелочи смещает равновесие вправо, идет связывание HCl |
|
Сложные эфиры |
Среда кислая (неорганическая кислота). Для смещения равновесия вправо гидролиз ведут в присутствии щелочи с образованием соли карбоновой кислоты и спирта
|
Щелочное окисление в промышленности |
|
Жир сложного эфира высших карбоновых кислот и глицерина. 1811 г. Э. Шеврель |
В живом организме гидролиз жира — ферментативный процесс. |
Производство мыла, глицерина В живом организме синтезируется жир, соответственный данному организму, и затем участвует в обменном процессе. |
|
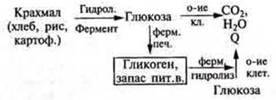
Углеводы. Крахмал Обмен углеводов (см. учебник биологии): |
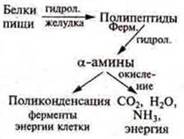
В живом организме гидролиз ферментативный. Схема 4, с. 161 учебника.
|
Глюкоза — важнейший энергетический материал в живом организме В промышленности продукты гидролиза: декстрины, мальтоза, глюкоза. Патока — смесь декстринов, мальтозы, глюкозы. Кондитерская пром-ть. Декстрины обладают клеющим действием. С ними связано появление корочки на хлебе, жареном картофеле; при накрахмаливании и глажении белья — плотной пленки |
|
Целлюлоза (отходы лесозаготовок): опилки, стружка; непищевое сырье — отходы переработки с/х культур: солома, шелуха и т. д. |
|
Получают глицерин, этиленгликоль, кормовые дрожжи; сорбит, этиловый спирт |
|
Биополимеры — белки (обмен белков; см. учебник биологии) |
|
В организме гидролиз до аминокислот, которые участвуют в синтезе белков, свойственных данному организму. Источник энергии в организме |
|
Гидролиз АТФ (аденозинтрифосфорная кислота) |
|
|