Поурочные разработки по химии 11 класс
Контрольная работа № 3 по теме «Химические реакции. Дисперсные системы. Процессы, происходящие в растворах» - ДИСПЕРСНЫЕ СИСТЕМЫ. РАСТВОРЫ. ПРОЦЕССЫ, ПРОИСХОДЯЩИЕ В РАСТВОРАХ - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цель урока: проверить уровень усвоения знаний учащихся.
Оборудование: карточки заданий по вариантам I—II.
Ход урока
I. Организационный момент
Инструктаж по выполнению заданий.
II. Выполнение заданий
Вариант I
1. Дать характеристику химической реакции по известным признакам:
![]()
2. Какие нужны условия: концентрация веществ, давление, температура системы, — чтобы сместить равновесие в сторону образования оксида углерода (II)?
![]()
3. Какие из перечисленных веществ способны гидролизироваться? Составить уравнения реакции:
бромэтан глюкоза
4. Составить уравнения возможных реакций в молекулярном и ионном виде между предложенными веществами:
сульфат натрия соляная кислота
оксид цинка сульфат калия
5. Вычислить массовую долю соли в растворе, полученном добавлением 20 г соли к 150 г раствора с массовой долей растворенного вещества 10 %.
Вариант II
1. Дать характеристику химической реакции по всем известным признакам:
![]()
2. Как надо изменить концентрации веществ, давление и температуру системы ![]() чтобы сместить равновесие в сторону образования оксида углерода (IV)?
чтобы сместить равновесие в сторону образования оксида углерода (IV)?
3. Какие из перечисленных веществ способны гидролизоваться? Составить уравнения реакций гидролиза:
хлорид серебра этилацетат.
4. Составить уравнения возможных реакций в молекулярном и ионном виде между предложенными веществами:
хлорид меди(II) гидроксид калия,
сульфат натрия оксид углерода(IV).
5. К раствору кислоты, массой 200 г с массовой долей 15 % добавлено 300 г воды. Какой стала массовая доля кислоты в новом растворе?
Ответы на вопросы контрольной работы № 3
Вариант I
1. ![]()
реакция замещения, ОВР
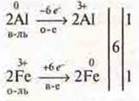
межмолекулярная ОВР;
реакция гомогенная — по фазе;
реакция экзотермическая — по тепловому эффекту;
реакция необратимая, реакция не каталитическая.
2. ![]()
т. к. реакция эндотермическая, t° — повысить;
т. к. объем увеличивается — Р понизить.
Для получения СО необходимо СCO2 — увеличить; ССO — уменьшить.

Вариант II
![]()
реакция окисления, реакция ОВР, межмолекулярная
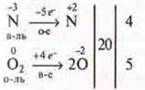
реакция эндотермическая — по тепловому эффекту;
реакция гомогенная — по фазе;
реакция необратимая, реакция каталитическая.
![]()
в сторону СО2, т. е. в сторону прямой реакции. Эта реакция экзотермическая, t° — понизить; Р — повысить, в сторону меньшего объема. Концентрации СCO и СO2 — повысить, ССO2— понизить.