Поурочные разработки по химии 11 класс
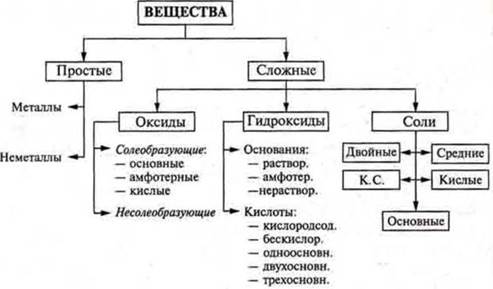
Классификация неорганических веществ - ВЕЩЕСТВА И ИХ СВОЙСТВА - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: обобщить и закрепить знания о классификации неорганических веществ; научить на основании состава молекулы вещества правильно называть вещества; рассмотреть взаимосвязь и взаимообусловленность состава, строения и свойства вещества; дать представление о значении неорганических веществ в повседневной жизни; дать понятие комплексного соединения.
Основные понятия: вещества простые — металлы, неметаллы; сложные — оксиды, кислоты, соли; гидроксиды — основания, гидроксиды — кислоты, амфотерность; двойные и комплексные соли; ион-комплексообразователь, лигатун, внутренняя сфера, внешняя сфера, координационное число.
Оборудование: коллекция «Металлы», «Неметаллы» — сера, графит; модели типов кристаллических решеток, таблица; Вr2, I2, фосфор красный; оксиды: Fe2O3, CuO, Аl2O3, СаО, Сr2O3; кислоты: H2SO4, HCl, HNO3; щелочи: NaOH, КОН, Na2CO3 NaHCO3, (CuOH)2CO3, KMnO4, NH3 · H2O, CuSO4; коллекция «Минералы и горные породы»; пробирки.
Ход урока
I. Организационный момент
Учитель анализирует результат выполнения контрольной работы № 3, акцентирует внимание учащихся на ошибках, допущенных в работе, объясняет правильное выполнение некоторых заданий. Предлагает учащимся сделать работу над ошибками и с целью повышения балла предлагает индивидуальные задания.
Далее учитель знакомит учащихся с новой темой «Вещества и их свойства», а также с темой урока: «Классификация неорганических веществ».
II. Изучение нового материала
Материал знаком, однако изучался он в 8 и 9 классах. Многое забыто. Необходимо, работая с текстом учебника, § 17, вспомнить состав, классификацию, номенклатуру неорганических веществ.
План изложения
1. Определение простых и сложных веществ.
2. Классификация простых веществ: металлы и неметаллы. Строение атомов, виды химической связи, типы кристаллических решеток, особенность свойств (составление таблицы).
3. Классификация сложных веществ; оксиды, гидроксиды: кислоты, основания; соли.
4. Характеристика сложного вещества по плану: определение, классификация, номенклатура, строение (химическая связь, кристаллическая решетка), физические свойства, значение в повседневной жизни.
На основании состава все вещества делятся на простые и сложные.
Вспомним определение простых и сложных веществ.
Простые вещества — молекулы состоят из атомов одного вида.
Пример: кислород, сера, азот.
Сложные вещества — молекулы состоят из атомов разного вида.
Пример: вода, оксид углерода (N2), серная кислота и т. д.
Все простые вещества на основании строения атомов, вида химической связи, типа кристаллических решеток, физических и химических свойств делятся на металлы и неметаллы.
Учащиеся в тетрадях составляют таблицу:
|
Вещество |
Строение атома |
Вид химической связи |
Строение простых веществ, тип кристаллической решетки |
Свойства вещества |
|
Все металлы Все неметаллы Благородные газы |
Малое количество электронов на внешнем энергетическом уровне (меньше, чем 3) Большое количество электронов на внешнем энергетическом уровне (больше, чем 4) Внешний энергетический уровень завершен (октет электронов или 2 у Не) |
Металлическая связь Ковалентная полярная связь Нет связей между атомами |
Металлическая кристаллическая решетка Молекулярная или атомная кристаллические решетки Молекулярная кристаллическая решетка |
Восстановительные свойства Окислительно-восстановительные свойства Инертны |
Учащиеся рассматривают коллекцию металлов и некоторые неметаллы, которые имеются в кабинете. Вспоминают типы кристаллических решеток, рассматривая их модели и по таблице (атомная, молекулярная, металлическая).
Какова же классификация сложных веществ?
Сложные вещества:
а) оксиды; б) основания; в) кислоты; г) соли.
Обобщающая и более полная классификация неорганических веществ представлена в учебнике § 17 стр. 179, схема 7.
В тетрадях следует, согласно этой классификации сделать записи но следующему плану:
1. Определение класса, общая формула.
2. Классификации; название.
3. Признаки (химическая связь) строения вещества, физические свойства.
4. Значение веществ в повседневной жизни.
Оксиды — сложные вещества, образованные двумя элементами, один из которых — кислород: ЭmОn.
По составу оксиды могут быть образованы металлами: СаО; РbО и неметаллами: СO2; NO2.
По свойствам оксиды бывают солеобразующие и несолеобразующие (также называют безразличными). Солеобразующие делятся на основные, кислотные и амфотерные. Основные оксиды образованы металлами, им соответствуют основания; кислотные оксиды, как правило, образованы неметаллами и металлами в максимальной С.О. Им соответствуют кислоты. Амфотерные оксиды образованы переходными элементами.
Пример: оксид бария — ВаО, основной оксид, т. к. Ва — типичный металл. Оксид серы(IV) — SO2, кислотный оксид, т. к. S — типичный неметалл. Оксид марганиа(VII) Мn2O7 — кислотный оксид, т. к. Мn — металлический элемент в максимальной С.О., оксид алюминия — Аl2O3 — амфотерный оксид, т. к. Al — переходный элемент.
В названии оксида обязательно указывается С.О., если образующий элемент имеет несколько С.О.
Пример: ![]() — оксид серы (IV);
— оксид серы (IV); ![]() — оксид серы (VI).
— оксид серы (VI).
Несолеобразующих оксидов не так и много, их следует запомнить:
СО — оксид углерода(II);
NO — оксид азота(II);
N2O — оксид азота(I).
Оксиды, образованные металлами, имеют ионную связь, переходными металлами — ковалентную полярную связь. Кристаллические решетки могут быть ионными и атомными:
оксид бария — ионная кристаллическая решетка;
оксид алюминия — атомная кристаллическая решетка;
минералы: корунд, сапфир, рубин.
Оксиды, образованные неметаллами, имеют ковалентную полярную связь, молекулярные (углекислый газ, «сухой лед»), атомные (оксид кремния (кварц, горный хрусталь, агат и т. д.) кристаллические решетки.
Учитель демонстрирует учащимся коллекцию минералов и горных пород, в состав которых входят оксиды: кварц (SiO2), корунд (Аl2O3), асбест (CaO · 3MgO · 4SiO2), тальк (3MgO · 4SiO2 ·H2O); глина: белая, красная: в состав входят оксиды: Аl2O3 · nН2O — белая; боксит Fe2O3 входит в состав красной глины. Руды железа: Fe2O3 — красный железняк, Fe3O4 — магнитный железняк.
В состав воздуха входят: оксид углерода (IV) — СO2, вода — Н2O, вредные примеси, СО — угарный газ, который образуется при неполном сгорании топлива.
Применение оксидов:
Н2O — вода; важнейший минерал Земли; участвует в круговороте веществ;
SiO2 — оксид кремния; входит в состав большинства минералов, встречающихся в природе: кремнезем, тальк, асбест, яшма, горный хрусталь, полевой шпат;
Fe2O3, Fe3O4 — руды для производства чугуна и стали;
СO2 — углекислый газ; круговорот веществ в природе; фотосинтез;
СО — угарный газ, яд; образуется при неполном сгорании топлива.
Всем оксидам соответствуют гидроксиды — соединения, состоящие из трех элементов, два из которых водород и кислород.
В зависимости от характера оксида, образуемый им гидроксид может быть основанием или кислотой. Основным оксидам соответствуют гидроксиды — основания. Пример, ВаО — Ва(ОН)2.
Основания — сложные вещества, состоящие из атомов металла и одной или несколько гидроксогрупп (—ОН):
![]()
По растворимости в воде основания бывают хорошо растворимые в воде — щелочи (КОН, NaOH), малорастворимые в воде (Са(ОН)2), нерастворимые в воде (Сu(ОН)2).
Основания имеют ионную связь между металлом и гидроксогруппой, в гидроксогруппе — ковалентная полярная связь. Кристаллическая решетка — ионная, твердая.
Особую группу оснований составляют нерастворимые в воде, которым соответствуют амфотерные оксиды С.О. +2, +3, +4. Такие основания также называются амфотерными. Они проявляют кислотно-основные свойства.
Пример:
![]()
Для них возможны ковалентные полярные связи и молекулярные кристаллические решетки.
Область применения оснований:
NaOH — гидроксид натрия, «едкий натр»; очистка нефтепродуктов, отбеливание бумаги, производство мыла, осушка газов в органическом синтезе;
Ca(ОН)2 — гидроксид кальция, каменная известь; в смеси с песком известковый раствор, побелка; производство сахарозы;
NН3 · H2О — гидрат аммиака, нашатырный спирт — медицина, аммиачная вода — жидкое азотное удобрение;
Al(ОН)3 — оксид алюминия; медицина — алмагель, препарат, обладающий обволакивающим адсорбирующим действием.
![]() — получение в лаборантки;
— получение в лаборантки;
Fе(ОН)3 — гидроксид железа (III) — компонент желтого пигмента для красок и эмалей, поглотительная масса для очистки природного газа; катализатор в органическом синтезе.
Кислотным оксидам соответствуют гидроксиды — кислоты.
![]() — общая формула кислот.
— общая формула кислот.
![]() — кислотный остаток (acid (англ.) — кислота).
— кислотный остаток (acid (англ.) — кислота).
По наличию кислорода в молекуле кислоты бывают кислородосодержащие (H2SО4, HNО3), бескислородные (HCl, H2S); по количеству атомов водорода в молекуле кислоты бывают одноосновные — HCl, HNO3; двухосновные — Н2СO3, H2S; трехосновные — Н3РO4.
Химическая связь между атомами в кислотах ковалентная полярная. Строение веществ — молекулярное.
Использование кислот:
H2SО4 — серная кислота; производство минеральных удобрений, тлей бескислородных кислот; очистка нефтепродуктов, поверхностей металлов; органический синтез: производство волокон, краски, лаков, лекарственных препаратов; взрывотехника; заливка аккумуляторов;
HNО3 — азотная кислота; производство азотных удобрений, лекарственных препаратов; органический синтез; окислитель ракетного топлива;
Н3РО4 — фосфорная кислота; производство фосфорных удобрений;
НСl — соляная кислота; травление металлов, производство соней, пищевая промышленность, медицина, органический синтез.
Многочисленный класс сложных веществ — это соли.
Соли — сложные вещества, состоящие из катионов металла и анионов кислотного остатка (это общее определение).
Соли бывают: а) средние; б) кислые; в) основные; г) двойные; д) комплексные.
Средние соли образуются при полном замещении атомов водорода в молекуле кислоты на атомы металла или полном замещении гидроксогрупп в молекулах оснований на кислотные остатки:
Н3РО4 - Na3PО4; Ва(ОН)2 - ВаСl2;
H2SО4 - K2SО4; Fe(OH)3 - Fe(NO3)3.
Кислые соли образуются при неполном замещении атомов водорода в молекулах кислот на атомы металла:
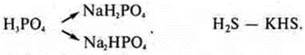
Основные соли образуются при неполном замещении гидроксогрупп в основаниях на кислотные остатки:
Fe(OH)3 - (FeOH)Cl2; Cu(OH)2 - (CuOH)NO3.
Двойные соли и комплексные соли отличаются друг от друга характером диссоциации в водных растворах. Двойные соли диссоциируют в одну ступень на катионы металлов и анионы кислотных остатков.
Пример: двойная соль KAl(SO4)2:
![]()
Комплексные соли при диссоциации образуют сложные комплексные ионы, которые устойчивы в водных растворах. Примера [Cu(NH3)4]SO4 — комплексная соль.
![]()
Для классов, имеющих повышенный уровень усвоения учебного материала, следует более подробно рассказать о комплексных соединениях.
Теория строения комплексных соединений разработана А. Вернером (швейцарский химик). Согласно теории А. Вернера, в центре комплексного соединения находится ион-комплексообразователь. Им может быть металл (в основном d-элементы — имеющие свободные орбитали), а также элемент, имеющий неподеленные пары электронов.
Вокруг иона-комплексообразователя находятся противоположно заряженные ионы или нейтральные молекулы, которые называются лигандами (аддендами). Ион-комплексообразователь и лиганды составляют внутреннюю сферу комплексного соединения, которую записывают в квадратные скобки. Число лиганд соответствует координационному числу иона-комплексообразователя. Наиболее характерны:
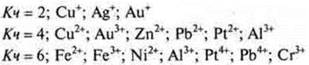
Заряд внутренней сферы равен сумме зарядов иона-комплексообразователя и лиганд.
Ионы, не вошедшие во внутреннюю сферу, образуют внешнюю сферу.
Опыт.
Получение [Cu(NH3)4]SO4.
CuSO4 + 4NH3 = [Cu(NH3)4]SO4 — темно-синий раствор.
Классификация комплексных соединений но заряду внутренней сферы:
а) катионные комплексы:
[Cu(NH3)4]2+ + SO42- название составляется, начиная с аниона молекулы; ион-комплексообразователя назван по-русски в родительном падеже:
Сульфат-тетрааммин меди (II)
б) анионные комплексы. Ион-комплексообразователь называем по латыни с суффиксом «ат»:
Na2+[Zn(OH)4]-2 — тетрагидроксоцинкат натрия;
в) нейтральные комплексы. Ион-комплексообразователь называем по-русски в именительном падеже: [Fe(CO)5] пента-карбонил-железо.
K+3[Fe+3(CN-)6]-3 — анионный комплекс гекса-ционо-феррат (III) калия.
[Co(Br)(NH3)5]SO4 — сульфат-пента-аммин-бромо-кобальта (III).
Рассмотреть строение комплексных соединений (как закрепление знании о комплексных соединениях).
![]()
[Ag(NH3)2]+ — внутренняя сфера;
Ag+ — ион — комплексообразователь;
2NH30 — лиганды;
Сl- — внешняя сфера;
Хлорид диаммин серебра (I).
Значение комплексных соединений в природе огромное. Хлорофилл, гемоглобин — это комплексные соединения живой клетки.
Хлорофилл — комплексное соединение, ионом-комплексообразователем является магний; хлорофилл отвечает за фотосинтез. Гемоглобин — комплексное соединение, ионом-комплексообразователем является железо. Гемоглобин отвечает за газообмен в клетке: снабжает клетку кислородом и удаляет углекислый газ. Витамин В-12 — это комплексное соединение кобальта. Таким образом, от комплексных соединений в живых организмах зависит обмен веществ.
В солях присутствует ионная связь, ковалентная полярная снизь, а в комплексных соединениях между ионом-комплексообразователем и лигандами — связь по донорно-акцепторному механизму.
В повседневной жизни соли имеют огромное значение (демонстрация некоторых солей). В быту NaHCО3 — гидрокарбонат натрия, пищевая сода; СаСО3 — карбонат кальция, мел, известняк, мрамор; стеарат Na, К — твердое и жидкое мыло; КМnO4 — дезинфицирующее средство: минеральные удобрения: азотные NH4NO3 — нитрат аммония, калийные KCl — хлорид калия, фосфорные (NH4)2HPO4 — гидрофосфат аммония.
В промышленности: соли катализаторы АlСl3; FeBr3; биологическое значение: соли NaCl, KCl; Na2HPO4; NaHCO3; CaF2; Са3(РO4)2; малахит (CuOH)2CO3 — минерал.
В конце урока в качестве итога можно предложить самостоятельно без учебника составить схему классификации неорганических веществ.
III. Домашнее задание
§ 17, с. 176—178. Дать названия, распределить согласно классификации:
S, Al(OH)3; H2SO3; NO; BaO; Р2O5; Hi; Mg(OH)2; CaSO4; Н3РO4; NaHSO4; (ZnOH)Cl; KNO3; Li2CO3; Na3[AlF6]; NH4Fe(SO4)2; CaHPO4.
Рекомендации учителю
На данном уроке учащимся можно предложить подготовить реферат-сообщения по простым веществам — металлам и их соединениям, а также по простым веществам — неметаллам и их соединениям. Сообщения будут заслушиваться на уроках-семинарах данной темы.
План сообщения
1. История открытия элемента. Почему так назван? Нахождение в природе, получение.
2. Особенности строения атома. Степени окисления.
3. Особенности физических свойств простых веществ. Химическая связь, кристаллическая решетка.
4. Особенности химических свойств.
5. Важнейшие области применения в чистом виде и в виде соединений.
Следует напомнить учащимся о том, что реферат-сообщение необходимо заранее показать учителю для ознакомления и получения рекомендаций.