Поурочные разработки по химии 11 класс
Классификация органических веществ - ВЕЩЕСТВА И ИХ СВОЙСТВА - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: обобщить и систематизировать знания о классификации органических веществ по разным признакам, закрепить знании о причинах многообразия органических веществ и зависимости их свойств от строения.
Основные понятия: углеводороды: насыщенные, предельные, ненасыщенные, непредельные; гетероциклические; монофункциональные, гетерофункциональные; циклоалканы.
Оборудование: коллекции «Нефть и продукты переработки»; каменный уголь, уксусная кислота, глицерин, жир. парафин, феном, олеиновая кислота, глюкоза, сахароза.
Ход урока
I. Проверка знаний учащихся
Даны формулы соединений:
Fе(ОН)2, SiO2, HNO3, SO2, N2O, КОН, С, Mg, NaOH, Li2O, ZnО, Cr(OH)3, Ca(HCO3)2, (FeOH)Cl2, H2S, P, Fe, BaO, NaHSO4, Pb(OH)2, CO, HCl, (CuOH)2CO3, H2SO3.
|
Вариант I |
Вариант II |
|
Выписать и дать названия согласно классификации: |
|
|
Неметаллы Кислотные оксиды |
Металлы Основные оксиды |
|
*** |
|
|
Бeзразличные оксиды Растворимые основания Амфотерные основания Основные соли Кислоты кислородсодержащие |
Амфотерные оксиды Нерастворимые основания Кислые соли Кислоты бескислородные Безразличные оксиды |
|
Ответы записать на обратной стороне доски. |
|
|
*** |
|
|
С - углерод Р - фосфор SiO2 — оксид кремния SO2 — оксид серы (IV) N2O — оксид азота I СО — оксид углерода II КОН — гидроксид калия NaOH — гидроксид натрия Cr(ОН)3 — гидроксид хрома (III) (AlOН)Сl2 — гидроксохлорид илюминия (CuOH)2CO3 — гидроксокарбонат меди (II) N2O — оксид азота (I) H2SO3 — сернистая кислота |
Mg — магний Fe — железо Li2O — оксид лития ВаО — оксид бария ZnO — оксид цинка Fe(OH)2 — гидроксид железа (II) Рb(ОН)2 — гидроксид свинца (II) Са(НСO3)2 — гидрокарбонат кальция NaHSO4 — гидросульфат натрия H2S — сероводородная кислота НСl — хлороводородная кислота СО — оксид углерода (II) HNO3 — азотная кислота |
По окончании выполнения провести самопроверку (ответы записаны на обратной стороне доски).
II. Изучение нового материала
План изучения
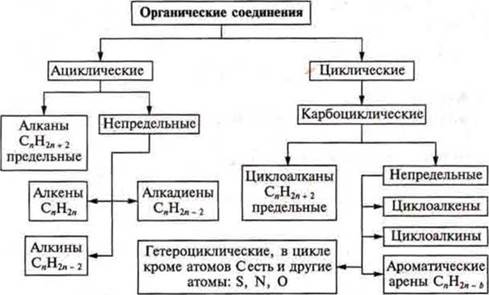
Классификация органических соединений по признакам:
а) вид углеродной цепи: ациклические — открытая цепь; циклические — замкнутые цепи; состоящие из атомов углерода — карбоциклические; и разных атомов — гетероциклические;
б) наличие кратных связей.
Классификация органических соединений
ациклические: алканы — предельные насыщенные, одинарные связи; алкены — двойная связь (непредельные ненасыщенные); алкадиены — две двойные связи (непредельные ненасыщенные); алкины — тройная связь (непредельнные, ненасыщенные);
циклические: арены — ароматические кольца у карбоциклических и гетероциклических; циклоалканы — все связи одинарные; циклоалкены — есть двойная связь; циклоалкины — есть тройная связь.
Рассмотрим классификацию органических соединений, если считать, что один или несколько атомов водорода в соединении замещены на группировку атомов, определяющих физические и химические свойства вещества. Такие группировки называются функциональными.
Органические соединения могут быть монофункциональными — одна функциональная группа; полифункциональные — несколько одинаковых функциональных групп; гетерофункциональные — в соединении разные функциональные группы.
В зависимости оттого, какой атом находится в функциональной группе, соединения бывают азотсодержащие, кислородсодержащие, галогенопроизводные и т. д.
Если углеводородный радикал предельный — соединение относился к предельным; если непредельный — соединение будет непредельным, того ряда, какова кратность связи.
III. Работа с учебником
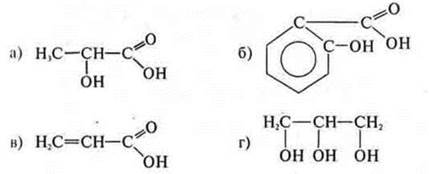
Работа с таблицей 15 на с. 183 учебника. Учащиеся вспоминают все функциональные группы, название классов на основании функциональной группы, общей формуле. В качестве закрепления знаний классификации органических соединений вместе с учителем учащиеся выполняют задание: дать классификацию органическому соединению, назвать соединения:
Ответ:
Вещество «а»:
ациклическое, предельное; —ОН — одноатомный спирт.
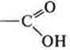 - карбоновая
- карбоновая
гетерофункциональное соединение: спиртокислота;
2-гидроксипропановая кислота.
Вещество «б»:
циклическое, арен; карбоциклическое:
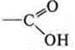 — карбоновая кислота — ароматическая;
— карбоновая кислота — ароматическая;
—ОН — группа связана с ароматическим кольцом; фенол, т. e. гетерофункциональное соединение.
2-гидрокси-бензойная кислота.
Вещество «в»:
ациклическое, непредельное (двойная связь)
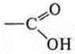 — кислота карбоновая.
— кислота карбоновая.
Монофункциональное соединение: пропеновая кислота.
Вещество «г»:
Ациклическое, предельное;
—ОН — группа спиртов, (три) полифункциональное, трехатомный спирт. Пропан-триол-1,2,3.
Учитель объясняет учащимся правильность составления общих формул некоторых органических спиртов (предельных).
Кислородсодержащие:
спирты: ![]()
фенолы: ![]()
альдегиды: ![]()
карбоновые кислоты: 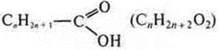
простые эфиры: ![]()
сложные эфиры: 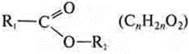
Азотосодержащие:
амины: ![]()
нитросоединения: ![]()
аминокислоты: 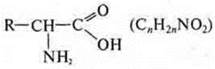
IV. Обобщения и выводы
1) Сочетание различных элементов строения и состава между собой создает разнообразие мира органических веществ. Полная характеристика соединения включает классификацию по строению углеродной цепи с учетом кратных связей в ней и по наличию функциональных групп. Следует помнить об изомерии органических соединений, ее видах.
2) Общие физические свойства органических веществ.
Агрегатное состояние: газы (СН4), жидкости (СН3СООН — уксусная кислота, С2Н5ОН — спирт), твердые — парафин, стеариновая кислота, фенол.
Тип связи в органических соединениях преимущественно ковалентный, т. к. органические соединения образованы атомами неметаллов С, N, О, К, а не ионами.
Кристаллические решетки — молекулярные или атомные. Межмолекулярные взаимодействия слабые. Поэтому типичные органические соединения — чаще всего жидкости или твердые вещества с низкой t° плавления и кипения, неэлектролиты, многие нерастворимы или плохо растворимы в воде.
Низшие спирты, альдегиды, кислоты, фенолы, эфиры имеют запах; летучие вещества.
Опыт:
а) плавление парафина;
б) возгонка нафталина или бензойной кислоты.
в) органические соединения при нагревании обугливаются. Обугливание древесины, сахарозы, крахмала.
V. Домашнее задание
§ 17. № 2, 3, 4, подготовиться к самостоятельной работе. Дать классификационную характеристику; определить, свойства каких классов проявляются:
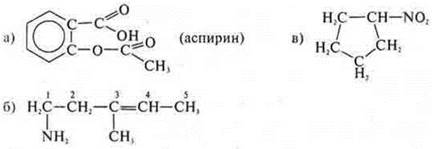
Ответы на вопросы домашнего задания
§ 17 № 2
С4Н10О, кислородосодержашее
![]() — ациклическое, предельное; одноатомный спирт (одна группа —ОН); бутанол-1.
— ациклическое, предельное; одноатомный спирт (одна группа —ОН); бутанол-1.
Изомеры положения функциональных групп:
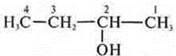 — бутанол-2;
— бутанол-2;
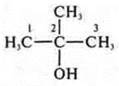 — 2-метилпропанол-2.
— 2-метилпропанол-2.
Изомер по углеродной цепи и положения функциональных групп:
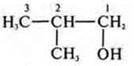 — 2-метилпропанол-1.
— 2-метилпропанол-1.
СН, ОН
Межклассовый изомер:
простые эфиры:
Н3С—О—С3Н7 метилпропиловый эфир,
С2Н5—О—С2Н5 диэтиловый эфир.
§ 17 № 3
С двойственными свойствами — вещества, проявляющие свойства двух классов органических соединений.
Метаналь 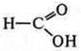 — альдегидокислота.
— альдегидокислота.
как кислота 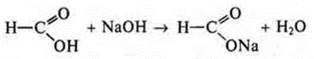
как альдегид 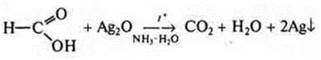 чон
чон
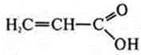 — пропеновая кислота
— пропеновая кислота
По радикалу — непредельная кислота
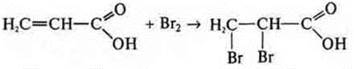
как кислота:
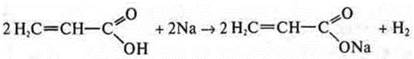
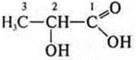 — 2-гидроксипропановая кислота.
— 2-гидроксипропановая кислота.
Молочная кислота; спиртокислота:
как спирт: 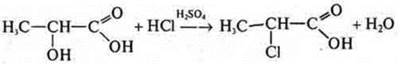
как кислота: 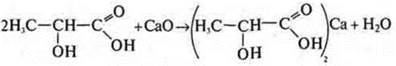
§ 17 № 4
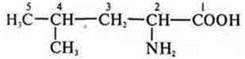 - ациклическое, предельное, азото-кислородосодержащее.
- ациклическое, предельное, азото-кислородосодержащее.
-NH2 -амин; -СООН -кислота.
Аминокислота, 2-амино-4-метилпентановая кислота.
Гомологи:
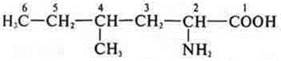
2-амино-4-метилгексановая кислота
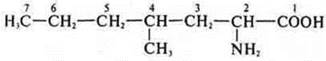
2-амино-4-метилгектановая кислота
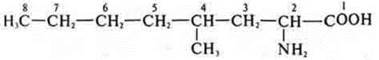
2-амино-4-метилоктановая кислота.
Изомеры:
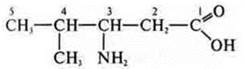
3-амино-4-метилпентановая кислота
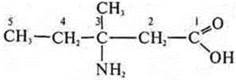
3-амино-3-метилпентановая кислота
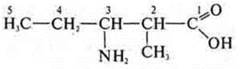
3-амино-2-метилпентановая кислота
Характеристика соединений
а) аспирин
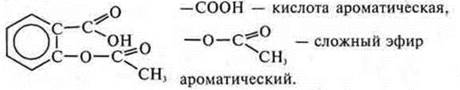
Свойства кислот, сложных эфиров и аренов.
Циклическое, карбоциклическое, ароматическое, кислородосодержащее.
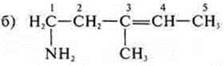
Ациклическое, непредельное, —NH2 — амин.
1-амино-3-метилпентен-3. Свойства аминов и непредельных углеводородов с двойной связью.
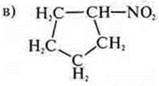
Циклическое, карбоциклическое, предельное, азото-кислородсодержащее.
— NО2 — нитросоединение.