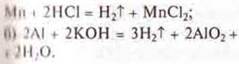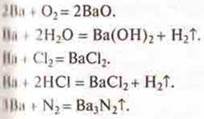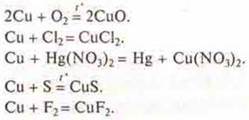Поурочные разработки по химии 11 класс
Оксиды и гидроксиды металлов - ВЕЩЕСТВА И ИХ СВОЙСТВА - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: научить составлять формулы оксидов и гидроксидов металлов, сравнивать их свойства, учитывая положение в ПСХЭ Д. И. Менделеева, степени окисления и радиусы ионов; закрепить знания особенностей свойств оксидов и гидроксидов, образованных металлами побочных подгрупп; дать представление о длинно-периодной периодической системе и появлении укороченной.
Основные понятия: оксиды, гидроксиды, амфотерность оксида, амфотерность гидроксида.
Оборудование: AlCl3, NH3, Н2O, КОН.
Ход урока
I. Обсуждение вопросов домашнего задания
№ 5 § 18.
При определении положения металла в ряду напряжений учитывается не только энергия отрыва электронов от отдельных атомов, но и энергия, затраченная на разрушение кристаллической решетки, а также энергия, выделяющаяся при гидратации ионов.
Пример: литий более активен в водных растворах, чем натрий (в ПСХЭ натрий по положению более активный, чем металл). Дело в том, что энергия гидратации ионов Li+ значительно больше, чем энергия гидратации ионов Na+, поэтому первый процесс является энергетически более выгодным.
№ 6 § 18
Наиболее активным является К, т. к. в ряду напряжений металлов он расположен левее всех предложенных металлов. Он является более сильным восстановителем.
№ 8 § 18
Полностью растворяется в разбавленной серной кислоте хромель (Ni, Сr, Со, Fe). Все металлы в ряду напряжений металлов расположены левее водорода и вытесняют его из разбавленных кислот.
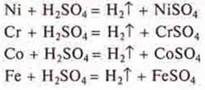
II. Тест
|
Вариант I |
Вариант II |
|
1. Металлический элемент. a) S; б) Ва; в) Al. |
1. Переходный элемент: a) Zn; б) Р; в) Na. |
|
2. Металл, способный вытеснить водород: |
|
|
из воды: а) Сu; б) Li; в) Рb. |
из раствора кислоты: а) Са; б) Ag; в) Hg. |
|
3. Из раствора соли сульфата меди (II) |
|
|
медь могут вытеснить. |
медь не вытесняют: |
|
a) Zn; б) Са; в) Fe; г) Na; д) Ag. |
|
|
4. Растворится ли образец смеси металлов |
|
|
Al, Мn, Сu в растворе. a) HCl; б) КОН. |
Fe, Ag, Zn в растворе: a) H2SO4; б) КОН. |
|
Составить уравнения реакций. |
|
Ответы на вопросы теста
|
Вариант I |
Вариант II |
|
1) «б»; 2) «б»; 3) «а», «в»; 4) а) в НСl;
|
1) «а»; 2) «а»; 3) «б», «г», «д»; 4) a)
|
III. Самостоятельная работа
|
Вариант I |
Вариант II |
|
1. Составить не более пяти уравнений реакций, характеризующих свойства |
|
|
бария. |
меди. |
|
2. Объяснить возможность протекания химических реакций (гидролиз соли не учитывать): |
|
|
|
|
Ответы на вопросы самостоятельной работы
|
Вариант I |
Вариант II |
|
1. Ba - очень активный металл:
|
1. Сu - металл малоактивный:
|
|
2.
Al стоит в ряду напряжений левее водорода, способен вытеснить его из раствора кислоты. |
2.
Реакция возможна, так как свинец расположен в ряду напряжений левее меди, его восстановительная способность больше меди. |
IV. Изучение нового материала
План изложения
1. Оксиды, образованные металлами, особенности их свойств в зависимости от С.О. элемента и радиуса иона; изменение свойств оксидов элементов в периодах и в группах, главных подгруппах.
2. Гидроксиды, образованные оксидами металлов; изменение характера гидроксида в зависимости от С.О. элемента и радиуса его иона.
3. Характер оксидов и гидроксидов, образованных металлами побочных подгрупп. ПСХЭ длиннопериодная и укороченная.
Все металлы образуют солеобразующие оксиды. Однако одни оксиды проявляют свойства основных оксидов, а другие проявляют кислотно-основные, то есть амфотерные свойства. От чего это зависит? Следует знать следующее — металл, проявляющий С.О. +1, +2 образует оксиды основного характера, т. к. это типичные металлы, которые расположены в I и II группах, главных подгруппах.
Пример: 1 группа, главная подгруппа представлена элементами Li, Na, К, Rb, Cs, Fe. К концу группы главной подгруппы у элементов возрастает атомный радиус. При отдаче электрона с внешнего уровня образуются катионы. С.О. у всех элементов к концу группы не изменяется, а вот характер оксидов — основной, будет усиливаться,
![]()
Усиливается основной характер
![]()
Возрастает радиус нового элемента
Если рассмотреть изменение свойств оксидов элементов по периоду на примере элементов III периода, то следует отметить, что в атомах этих элементов количество энергетических уровней одинаково, однако изменяется С.О. К концу периода она возрастает, что вызывает уменьшение радиуса иона. Вследствие чего характер оксида изменяется от основного через амфотерный к кислотному.
![]()
С.О. возрастает
![]()
Радиус иона уменьшается, характер оксида изменяется от основного к амфотерному
Оксидам металлов соответствуют гидроксиды. Если С.О. металлов +1, +2, +3, +4, то они образуют оксиды: ![]() и гидроксиды:
и гидроксиды: ![]()
Характер гидроксида зависит также от С.О. элемента и радиуса иона. Чем больше С.О., тем меньше радиус иона, характер гидроксида в большей степени кислотно-основной, то есть проявляет амфотерность:
в периодах:
Пример: III период.
Гидроксиды: ![]()
Ослабление свойства основания, усиление кислотного свойства
![]()
Возрастает С.О.: уменьшается радиус иона; щелочь, основание, амфотерное основание.
в группах, главных подгруппах:
Пример: I группа, главная подгруппа.
![]()
С.О. не изменяется
![]()
Возрастает радиус иона, усиливаются свойства гидроксидов как оснований
Переходные элементы, расположенные в малых периодах — это Ве (II период), Аl (III период), образуют оксиды BeO, Аl2O3 и гидроксиды Ве(ОН)2 и Аl(ОН)3 — проявляющие амфотерные кислотно-основные свойства. Что это означает?
Эксперимент
Al(OH)3: а) получение, б) кислотно-основные свойства.
Основные свойства: взаимодействие с кислотами, оксидами и гидроксидами.
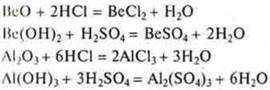 (эксперимент)
(эксперимент)
Кислотные свойства: взаимодействие с щелочами и оксидов, и гидроксидов.
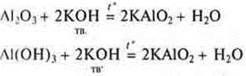
и если раствор щелочи, то образуется комплекс
![]() (эксперимент)
(эксперимент)
Итак, с увеличением С.О. металла происходит уменьшение радиуса иона металла, свойства оксидов и гидроксидов металлов изменяются от основного к кислотно-основному, а далее проявляют кислотный характер.
У элементов побочных подгрупп изменение С.О. можно рассмотреть на примере одного металла.
Пример: металл хром может проявлять С.О. +2, +3, +6.
![]() — основной оксид, гидроксид Сr(ОН)2 — основание;
— основной оксид, гидроксид Сr(ОН)2 — основание;
![]() — амфотерный оксид, гидроксид Сr(ОН)3 — амфотерное основание;
— амфотерный оксид, гидроксид Сr(ОН)3 — амфотерное основание;
![]() — кислотный оксид, гидроксид Н2СrO4, Н2Сr2O7 — кислота.
— кислотный оксид, гидроксид Н2СrO4, Н2Сr2O7 — кислота.
Нам известно, что С.О. максимальная определяется по номеру группы. Элемент хром расположен в VI группе, побочной подгруппе. Элемент сера также расположен в VI группе, только главной подгруппе. В высшей степени окисления они образуют кислотные оксиды ![]() которым соответствуют кислоты Н2СrO4 и H2SO4. Знание такого сходства многих элементов позволило Д. И. Менделееву построить укороченную таблицу химических элементов, где в отличие от длиннопериодной кроме групп появились подгруппы главная и побочная. Все элементы одной группы проявляют максимальную валентность, С.О. соответственно равна номеру группы.
которым соответствуют кислоты Н2СrO4 и H2SO4. Знание такого сходства многих элементов позволило Д. И. Менделееву построить укороченную таблицу химических элементов, где в отличие от длиннопериодной кроме групп появились подгруппы главная и побочная. Все элементы одной группы проявляют максимальную валентность, С.О. соответственно равна номеру группы.
Вернемся к примеру с хромом.
![]() — оксиды
— оксиды
![]() — гидроксиды
— гидроксиды
1) Что происходит со С.О.?
Ответ: С.О. возрастает.
2) Как вы думаете, а радиус иона как изменяется?
Ответ: радиус иона хрома с увеличением С.О. уменьшается.
3) Как эти изменения сказываются на свойствах соединения?
Ответ: происходит изменение свойств оксидов и гидроксидов от основного, через амфотерный к кислотным.
V. Обобщения и выводы
1. Всем типичным металлам соответствуют оксиды основного характера, а их гидроксиды — основания;
2. Переходные металлы d-элементы образуют несколько оксидов и гидроксидов. В зависимости от изменения С.О. и радиуса иона в данных соединениях свойства изменяются. При увеличении С.О. радиус иона уменьшается, ослабевают основные свойства, нарастают кислотно-основные, а затем кислотные как у оксидов, так и у гидроксидов.
3. В одной группе ПСХЭ Д.И. Менделеева, но в разных подгруппах расположены элементы, у которых валентность максимальная. С.О. соответственно равна номеру группы.
VI. Домашнее задание
§ 18, с. 206-207. № 4, 10 с. 223.
VII. Закрепление
Задание: Составить формулу оксида и гидроксида хрома (III). Уравнениями реакций подтвердить их амфотерность.
Ответ: Сr2O3 — оксид хрома (II).
![]() — основной оксид взаимодействия с кислотой.
— основной оксид взаимодействия с кислотой.
![]() — кислотный оксид взаимодействия с щелочью.
— кислотный оксид взаимодействия с щелочью.
![]() — гидроксил хрома (III).
— гидроксил хрома (III).
![]() — осадок исчезает.
— осадок исчезает.
Гидроксид хрома — основание, взаимодействует с кислотой.
![]() — осадок исчезает.
— осадок исчезает.
Гидроксид хрома проявляет кислотные свойства, т. к. взаимодействует с растворами щелочи.