Поурочные разработки по химии 11 класс
Коррозия металлов - ВЕЩЕСТВА И ИХ СВОЙСТВА - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: повторить и расширить представления о коррозии, ее видах, механизмах; закрепить знание способов зашиты металлов коррозии.
Основные понятия: коррозия, химическая коррозия, электрохимическая коррозия, процессы окисления, восстановления, протектор, пассивация, ингибитор.
Оборудование: Zn — проволока, гранула; Сu — проволока; НСl — разб. CuSO4.
Электролиты NaOH (10%), Н2О — дист., железные гвозди — 5; NaCl — р-р, К3[Fe(CN)6], железо луженое и оцинкованное; 5 пробирок № 1 - Fe, NaOH; № 2 - Fe, NaCl; № 3 - Fe, Cu, NaCl; № 4 – Fe, Zn, NaCl; № 5 — Fe, H2O; № 1 — HCl, луженое железо, 1—2 кап. К3[Fe(CN)6]; № 2 — HCl, оцинкованное железо, 1 т. 2 к., K3[Fe(CN)6].
Ход урока
I. Организационный момент
Итоги самостоятельной работы, анализ допущенных ошибок, объяснение правильности выполнения некоторых заданий.
II. Обсуждение выполнения домашнего задания
№ 4 § 18
![]()
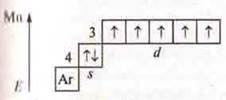 Максимальная С.О. +7. Оксид
Максимальная С.О. +7. Оксид ![]() — кислотный оксид, ему соответствует кислота НМnO4.
— кислотный оксид, ему соответствует кислота НМnO4.
Металлический элемент
![]()
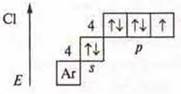 Максимальная С.О. +7. Оксид
Максимальная С.О. +7. Оксид ![]() — кислотный оксид, ему соответствует кислота НСlO4.
— кислотный оксид, ему соответствует кислота НСlO4.
Неметаллический элемент
На основании строения атома Мn — металлический элемент и Сl — неметаллический атом и максимальной С.О. образуют кислотные оксиды, которым соответствуют кислоты. В ПСХЭ Д. И. Менделеева Мn и Сl располагаются в одной группе VII, но в разных под группах. Cl — в главной подгруппе, Мn — побочной.
№ 10 § 18
а) Be, Mg, Са; С.О. у всех элементов +2, т. к. они расположены во II группе, главной подгруппе, на внешнем энергетическом уровне имеют два электрона. Это типичные металлы. Радиус атомов у этих элементов различен. От Be к Са радиус атома возрастает, металличность усиливается от Be к Са. Они образуют оксиды BeO, MgO СаО, характер которых изменяется от амфотерного ВеО к основному СаО. Гидроксиды, образованные данными элементами — основания, характер которых изменяется от амфотерного — Ве(ОН)2, проявляющего кислотно-основной характер до основания с ярко выраженным свойством типичного основания;
б) Na, Mg, Al. Металлы расположены в III периоде ПСХЭ Д. И. Менделеева. От Na к Аl возрастает заряд ядра, увеличиваете количество электронов внешнего энергетического уровня, радиус атомов сжимается — металлические свойства ослабевают, нарастают неметаллические.
Na — металл, Mg — металл, Аl — переходный элемент. С.О. возрастает от +1 до +3. Элементы Na, Mg, Al образуют оксиды ![]() ,
, ![]() характер которых изменяется от основного к амфотерному, С.О. возрастает, радиус ионов уменьшается.
характер которых изменяется от основного к амфотерному, С.О. возрастает, радиус ионов уменьшается.
Данным оксидам соответствуют гидроксиды NaOH — щелочь Mg(OH)2 — основания, Аl(ОН)3 — амфотерное основание, проявляет кислотно-основные свойства. Таким образом, к концу периода ослабевает металличность, ослабевает основной характер оксида, усиливается кислотный характер, через амфотерный. Характер гидроксидов изменяется от основания, через амфотерность к кислоте вследствие уменьшения радиуса атома, радиуса иона и увеличения С.О.: наблюдается усиление кислотного характера.
III. Изучение нового материала
План изложения
1. Работа с текстом учебника с. 208. Определение коррозии металлов.
2. Общие представления о коррозии металлов.
3. Виды коррозии: а) химическая коррозия; б) электрохимическая коррозия, влияние среды на электрохимическую коррозию.
4. Способы зашиты от коррозии:
· пассивация металлов;
· создание шлифованных поверхностей;
· электрохимический метод защиты: а) протекторное: б) катодное;
· обработка среды: а) введение веществ, замедляющих коррозию, ингибиторов коррозии; б) удаление растворенного О2 — деаэрация.
5. Способность металлов коррозировать (сообщение учащихся).
Изучение нового материала начинается с чтения текста § 18 с. 208. Понятие «коррозия» записывается в тетрадь.
Коррозия — это процесс самопроизвольного разрушения металлов и сплавов пол влиянием внешней среды (лат. corrosto — разъедание).
Все металлы — восстановители. Явление коррозии есть проявление восстановительных свойств металлов. Знание сути этого процесса даст возможность защитить металл от коррозии. Вещества, вызывающие коррозию металлов — это окислители, такие как неметаллы (кислород и др.), вода, неорганические и органические кислоты, оксиды, щелочи. Они в какой-то мере могут находиться в окружающей среде — воздухе, почве, воде.
Окисленной формой металлов являются их оксиды.
Пример: В результате коррозии железа образуется оксид железа (III). который входит в состав ржавчины — nFe2O3 · mН2O. Понятие «ржавление» характеризует конкретно коррозию железа. Ржавчина пориста, отслаивается и не защищает железо от дальнейшего разрушения. Вследствие коррозии разрушается огромное количество железа. В XIX веке половина выплавленного железа разрушалось, т. к. не было известно надежных методов борьбы с коррозией. В настоящее время 1/6 часть выплавленного чугуна превращается в ржавчину. Делается такой вывод из выше сказанного: борьба с коррозией железа и его сплавами — важнейшая задача, стоящая перед человечеством.
Вопрос: В столице Индии Дели стоит шесгитонная железная колонна, сделанная в начале V века. Она не подвергается коррозии, даже несмотря на влажный и теплый климат Индии, который должен благоприятствовать протеканию коррозийных процессов. Почему?
Ответ: Данная колонна практически на 99,8% изготовлена из железа. До сих пор не ясно, как индийским мастерам удалось в древности получить чистое железо.
Современная промышленность и техника эксплуатирует металлы и их сплавы часто при высокой температуре, высоком давлении, в агрессивных средах — кислотах, щелочах, солях; да и воздух и отличается чистотой, особенно в крупных городах. Борьба а сохранение металла от разрушения — коррозии — одна из главнейших задач современности, значимая.
Чтобы лучше защитить металл от коррозии, необходимо па пять ее химическую сущность.
Коррозия — окислительно-восстановительный процесс, протекающий в разных средах. Сухая среда — газовая коррозия, сред жидкость — жидкостная коррозия. Жидкую среду могут представлять электролиты, неэлектролиты. Различают таким образом коррозию химическую и электрохимическую.
При химической коррозии наблюдается прямое взаимодействие металла с окислителем, наблюдается переход электронов с атома металл на частицы, атомы, молекулы среды. В атмосфере часто присутствую выбросы промышленных предприятий, таких как SО2 — оксид серы (IV).
Возможна химическая коррозия по уравнению

В составе природного газа возможна примесь — сероводород, который вступает в реакцию с металлической трубой, по которой транспортируют газ. Сопла ракетных двигателей взаимодействуют окислителем топлива. Детали нефтедобывающих конструкций взаимодействуют с нефтью и продуктами ее переработки.
Однако в естественных условиях коррозия преимущественно протекает по другому типу. Как правило? изделия из металла соприкасаются с электролитами — водными растворами кислот, солей щелочей, то есть с токопроводящей средой.
Такая коррозия называется электрохимической. Вода — слабый электролит, который часто как пленка присутствует на поверхности металла. В этой пленке растворяются газы атмосферы — кислород, углекислый газ, примеси в виде SО2 — оксида серы (IV), NO2 - оксида aзотa (IV) и т. д., в результате образуется кислотный слой. Следует знать, что соприкосновение металлов может быть непосредственно с электролитами. При хранении металлов в атмосферных условиях электролиты могут образоваться сразу, если в емкость попадает вода, влажный воздух. Это характерно для больших городов, промышленных центров.
Большинство металлических конструкций — опоры мостов, нефтевышки, группа речного и морского транспорта — непосредственно находятся в контакте с речной, озерной, морской водой, где растворены соли, в контакте с почвой, где также присутствуют соли.
Электрохимическая коррозия существенно отличается от химической коррозии (показать эксперимент с гвоздем). В водной среде присутствует окислитель — растворенный в ней кислород и малое количество катионов водорода, которые образуются при диссоциации поды. Возможно восстановление катиона водорода:
![]()
и востановление кислорода:
![]()
Для этих процессов электроны представляются атомами металлов, т. к. они восстановители:
![]()
Преобладание того или иного процесса восстановления зависит от среды. В кислой среде преобладает процесс восстановления водорода, катион водорода Н+ — окислитель металл. Если среда щелочная, нейтральная — окислитель кислород.
В результате электрохимической коррозии всегда возникает электрический ток. Сила тока будет зависеть от того, какие примеси присутствуют в металлах, а также какие металлы находятся в контакте.
Опыт.
1. Сравнить скорости реакций двух экспериментов (кодоскоп).
а) взаимодействие цинка с раствором соляной кислоты. Наблюдается выделение водорода:
![]()
б) к грануле цинка прикоснуться медной проволокой. Наблюдается очень быстрое выделение водорода. Скорость реакции повысилась.
2. Сравнить скорость реакции цинка с соляной кислотой вначале, а затем добавляем несколько капель раствора CuSO4. Скорость реакции возросла. Почему так происходит?
1. Цинк более активный металл, чем медь. При соприкосновении гранулы цинка с медной проволокой электроны от более активного металла Zn переходят к менее активному металлу меди: ![]() на границе цинка образуется слой из катионов цинка. Это положительный слой, а медная проволока приобретает отрицательный заряд, становится катодом, где очень быстро начинают разряжаться катионы водорода:
на границе цинка образуется слой из катионов цинка. Это положительный слой, а медная проволока приобретает отрицательный заряд, становится катодом, где очень быстро начинают разряжаться катионы водорода: ![]()
Уравнение реакции в общем виде выглядит так:
![]()
Наблюдается направленное движение электронов — возникает электрический ток.
Во втором опыте при добавлении раствора CuSO4 происходит следующее. Цинк активнее меди, поэтому начинает вытеснять ее из раствора соли. Медь оседает на грануле цинка, а далее, как и в первом опыте, участки чистой меди заряжаются отрицательно, становятся катодом, где быстро разряжаются атомы водорода.
Далее необходимо рассмотреть рис. 41 учебника на с. 211 «Процесс разрушения железного образца в присутствии примеси меди в среде кислой, щелочной и нейтральной» в сравнении с проведенными экспериментами. Сделать записи в тетради.
2. Железо активнее меди, происходит отдача электронов, атом железа приобретает заряд частицы 2+, становится анодом ![]() Электроны направленно передвигаются к частице примеси из меди вследствие чего она приобретает отрицательный заряд — становится катодом. Если эта частица-примесь имеет контакт со средой электролита, где присутствуют катионы водорода, происходит их разрядка
Электроны направленно передвигаются к частице примеси из меди вследствие чего она приобретает отрицательный заряд — становится катодом. Если эта частица-примесь имеет контакт со средой электролита, где присутствуют катионы водорода, происходит их разрядка ![]() Суммарно уравнение процесса выглядит так:
Суммарно уравнение процесса выглядит так:
![]()
В случае щелочной и нейтральной среды процесс разрядки атомов железа происходит так же: ![]() Однако на частице примеси из меди-катода будет разряжаться кислород с образованием гидроксид-ионов:
Однако на частице примеси из меди-катода будет разряжаться кислород с образованием гидроксид-ионов: ![]() далее катионы железа и гидроксид-анионы образуют гидроксид железа (II):
далее катионы железа и гидроксид-анионы образуют гидроксид железа (II): ![]() который в присутствии кислорода и воды переходит в гидроксид железа (III):
который в присутствии кислорода и воды переходит в гидроксид железа (III):
![]()
В дальнейшем при разложении гидроксила железа (III) при нагревании — солнечная энергия — образуется оксид железа (III) Fe2O3, который входит в состав ржавчины.
IV. Обобщения, выводы
1. Коррозия — окислительно-восстановительный процесс.
2. Коррозия бывает химическая и электрохимическая.
3. В случае электрохимической коррозии всегда образуется электрический ток. Наблюдается разрушение более активного металла, который выступает в роли анода, а менее активный металл — в роли катода.
4. Скорость коррозии зависит от восстановительной способности контактирующих металлов. Чем сильнее они отличаются по восстановительной способности, тем больше скорость реакции.
Далее учащимся предлагается небольшое сообщение о способности металлов коррозировать.
Всe типичные металлы в главных подгруппах I и II групп ПСХЭ Д. И. Менделеева имеют малую коррозионную стойкость. Металлы побочной подгруппы I группы — стойкие. Это Сu, Ag, Аu. С увеличением порядкового номера элемента она возрастает.
Металлы побочной подгруппы II группы более устойчивы, т. к. на их поверхности под действием кислорода внешней среды образуются прочные оксидные пленки, защищающие от среды.
Металлы III группы, главной подгруппы. Например, Аl защищен оксидной пленкой, которая обладает высокими защитными свойствами, однако может разрушаться в кислотах и щелочах.Al пассивируется с поверхности концентрированных H2SO4 и HNO3.
Металлы IV группы, главной подгруппы Sn и Рb стойки к коррозии, покрыты прочной оксидной пленкой.
Металлы V, VI, VII, VIII групп побочных подгрупп способны к пассивации, обладают большой корозиционной стойкостью. Наибольшей устойчивостью обладают металлы VIII группы, побочной подгруппы Os, Ir, Pt. Железо пассивируется на холоде с поверхности концентрированных азотной и серной кислотах.
На кодотранспоранте можно показать следующую таблицу.
|
Признаки |
I |
II |
III |
IV |
V |
VI |
VII |
VIII |
Чем больше порядковый номер, тем выше антикоррозионная устойчивость |
||||
|
Гл. |
+ особ. Me |
Гл. |
Поб. |
Гл. Al |
Поб. |
Гл. |
Поб. |
Поб. |
Поб. |
Поб. |
Поб. |
||
|
Высокая коррозионная стойикость |
|
|
|
+ |
+ |
|
+ |
|
+ |
+ |
|
+ |
|
|
Низкая коррозионная стойикость |
+ |
|
+ |
|
|
|
|
|
|
|
|
|
|
|
Пассивируются в HNO3(к) и H2SO4 (к) |
|
|
|
|
+ |
|
|
|
+ |
+ |
|
+ |
|
|
Покрыты прочной оксидной пленкой |
|
|
|
+ |
+ |
|
+ |
|
+ |
+ |
+ |
|
|
Таким образом, зная все виды коррозии и химические процессы, протекающие при коррозии, можно предложить следующие методы защиты металлов от коррозии.
1. Изоляция металлов от внешней среды:
а) неметаллические покрытия металлов лаком, краской, эмалью, смолой, маслом, полимерами;
б) металлическое покрытие металлов — цинкование, аллюминирование, меднение, хромирование, никилирование, золочение, серебрение. Все эти покрытия создают декоративный вил изделиям. Металл цинкуют, если среда водная; в случае работ в серной кислоте покрывают свинцом, т. к. свинец пассивируется серной кислотой с образованием слоя PbSО4.
Лужение металла — покрытие кухонной посуды оловом. Белая жесть применяется для консервирования.
Опыт.
Металлические покрытия от действия соляной кислоты защищают резиной, феноло-формальдегидной смолой. Для деталей автомобилей применяют антикоррозийные покрытия в виде каучука, эпоксида, мастики на битумной основе.
В два раствора соляной кислоты добавить соль K3[Fe(CN)6]. В один раствор опустить процарапанную пластинку белой жести (железо, покрытое оловом), в другой — процарапанную оцинкованную пластинку (железо, покрытое цинком). Результат наблюдения следующий: в первом растворе наблюдается изменение цвета, т. к. олово менее активно, чем железо, и в растворе разрушаться будет вначале железо: ![]()
![]() а раствор K3[Fe(CN)6] — реактив на присутствие Fe2+, дает темно-синее окрашивание (турбуленова синь). В случае с оцинкованной пластинкой вначале будет разрушаться более активный металл — цинк:
а раствор K3[Fe(CN)6] — реактив на присутствие Fe2+, дает темно-синее окрашивание (турбуленова синь). В случае с оцинкованной пластинкой вначале будет разрушаться более активный металл — цинк: ![]() и окрашивание раствора не происходит.
и окрашивание раствора не происходит.
в) проводят обработку среды:
нагревание воды — при нагревании растворимость газов уменьшается;
пропускание воды через железную стружку — удаление кислорода — деаэрация;
добавление в воду сульфита натрия — химическое удаление кислорода:
![]()
г) осуществляют химическое покрытие: оксидирование, азотирование, науглероживание поверхности, введение веществ замедляющих коррозию — ингибиторов.
д) для разрушения окалины-ржавчины на оружейном металле применяют «травильные супы» — раствор H2SO4 с добавлением пивных дрожжей, крахмала, муки. При перевозке соляной кислоты применяют бутиламины. Известно свыше 5 тыс. ингибиторов атмосферы амины, нитриты аминов, сложные эфиры.
2. Создание шлифованных поверхностей, чтобы не задерживалась влага, лучше образовывалась оксидная пленка, т. к. поверхностный слой становится однородным.
Пассивация металлов — изготовление сплавов с добавлением ме- | ii.iюн Cr, Ni, AI, Mn, Mo, W, V, имеющих защитные оксидные пленки.
3. Электрохимические методы защиты:
а) протекторная — анодная защита. К металлоконструкции прикрепляется более активный металл (анод). Таким образом зашищают корпуса судов, нефтевышки, трубопроводы. В качестве активного металла используют Mg, Al, Zn;
б) катодная защита — металлическая конструкция присоединяется к катоду внешнего источника так, чтобы исключить возможность ее анодного разрушения.
Опыт.
Эксперимент по электрохимической коррозии железа следует готовить за несколько дней до урока.
5 пробирок:
№ 1: Fe, NaOH; № 2: Fe, NaCl; № 3: Fe, Cu; № 4: Fe, Zn, NaCl; № 5: Fe, H2O — кипяченая.
Железные гвозди в пробирке № 3 соединены с медной проволокой; в пробирке 4 — с цинковой проволокой.
После добавления в растворы всех пробирок 1—2 к. K3[Fe(CN)6] изменение цвета до синего, отмечается интенсивность изменения циста и скорости коррозии.
V. Домашнее задание
§ 18 с. 208-214. С. 223. № 17, 18. 19 (устно).
VI. Закрепление
№ 14, 15. 16 § 18.
Ответ:
№ 14 § 18. Коррозия — самопроизвольное разрушение металлов и сплавов под воздействием внешней среды. Коррозия бывает химической и электрохимической. Электрохимическая коррозия представляет физико-химический процесс.
№ 15 § 18. а) это химическая коррозия: б) это электрохимическая коррозия — разрушение в токопроводящей среде.
№ 16. а) если покрыто оловом: pH > 7, при повреждении будет разрушаться железо — более активный металл.
![]()
![]()
б) в кислой среде, pH < 7
![]()
Если покрыто цинком: при pH ≥ 7, pH < 7.
При повреждении будет разрушаться цинк, как более активны материал.
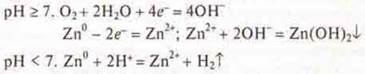
Ответы на домашнее задание
§ 18 № 18.
а) да, магний активнее железа и будет разрушаться в первую очередь;
б) нет, Рb менее активен, чем железо; в первую очередь будет разрушаться железо;
в) Ni — никель менее активен, чем железо, но покрыт защитной, прочной оксидной пленкой. Она не разрушается и не дает разрушаться никелю. Железо будет защищено.
§ 18 № 19. Краска «серебрянка» или «серебрин» в составе содержит порошок алюминия. Al покрыт очень прочной антикоррозийной оксидной пленкой. Аl не коррозирует и поверхность цистерн на определенное время (пока не «испортится» — высохнет) и благодаря растительному маслу защищена от внешней среды.