Поурочные разработки по химии 11 класс
Урок-семинар по теме «Электронное строение атома»
Цели урока: обобщить знания об электронном строении атомов химических элементов; закрепить умения и навыки в составлении электронных формул атомов химических элементов, а также их графических изображений; отработать основные понятия: элементарные частицы микромира, двойственная природа микрочастиц, электронное облако, атомная орбиталь, радиус АО, квантовые числа и их характеристика, семейство элементов, электронная формула, графическое изображение электронной формулы; симметричность атома.
Оборудование: ПСХЭ Д.И. Менделеева; вопросы семинара (теории и практики) на кодотранспоранте или в распечатанном виде.
Ход урока
I. Организационный момент
Обсуждение вопросов теории можно организовать работой в группах. Следует отметить, что вопросы теории включают узловые вопросы темы, а также вопросы домашнего задания. В каждой группе (не более 5 учащихся) разного уровня успеваемости по предмету совместно обсуждаются вопросы, даются ответы в устной форме. Старший в группе фиксирует работу каждого учащегося.
Учитель может распределить вопросы теории (по два) на каждую группу, а затем дается устный ответ. Подготовка ответа — не более 5—7 минут. Обсуждение вопросов теории не более 1,5 минут.
В дальнейшем выполняются вопросы практической части (желательно в каждой группе выполнить все задания). На выполнение и обсуждение вопросов практики 10—15 минут.
В оставшиеся 10 мин урока учащемуся необходимо выполнить самостоятельную работу по вариантам I—II. Учитель регулирует время обсуждения вопросов и ответов. 45 минут урока вполне достаточно для решения всех целей и задач семинара.
Теоретическая часть
1. Какие модели строения атома известны?
2. Какова современная модель строения атома?
3. Состав ядра атома. Изотопы.
4. Объяснить «двойственную природу» частиц микромира.
5. Дать определение понятиям «электронное облако», «атомная орбиталь», «радиус АО».
6. Квантовые числа и их использование для характеристики состояния электрона в атоме.
7. Какие принципы и правила заполнения электронных оболочек атомов известны? Что было бы, если бы не соблюдался принцип Паули? Правило Хунда?
8. На какие электронные семейства распределены все химические элементы? Почему?
9. Что такое электронная формула и ее графическое изображение?
10. Что такое «провал» электрона?
Пример химического элемента, у которого такое явление наблюдается. В чем причина «провала» электрона?
Практическая часть
1. Каков состав атомов химических элементов?
а) № 37; б) № 50; в) № 74; г) № 56; д) № 80.
2. Могут ли существовать такие орбитали?
a) 1d; б) 5f; в) 3р; г) 2dd; д) 6d.
Дать обоснованный ответ.
3. Могут ли электроны атомов следующих элементов находиться на следующих орбиталях?
а) Са — 2р; 1р; 4р; 3d; 3s;
б) Si — 4s; 2р; 3р; 2d; 3s;
в) Br — 1р; 2d; 2р; 4s; 3d;
г) Mn — 1s; 2р; 2d; 4р; 4s;
д) Sr — 6s; 3d; 4d; 4p; 2p.
Дать обоснованный ответ.
4. Определить, какие элементы представлены формулами:
a) 3s2; б) 4s23d6; в) 4s24p3; г) 5s24d1, д) 3s23p5.
Дать обоснованный ответ.
II. Самостоятельная работа
|
Вариант I |
Вариант II |
|
Составить электронные и электронно-графические формулы элемента. |
|
|
№ 56 |
№ 39 |
|
Определить элемент, которому соответствует формула. |
|
|
а) 6s1 б) 4s23d2 |
a) 5s24d5 б) 3s23p2 |
|
Дать обоснованный ответ. |
|
Урок-семинар заканчивается подведением итогов работы учащихся в группах, используя отчет старших в группе, и выставлением поурочного балла.
Желательно на проверку взять рабочие тетради учащихся, имеющих некоторые проблемы в изучении предмета, а также тетради учащихся, желающих сдать их.
Следует сделать анализ выполнения не только практической части семинара, но и выполнения домашних заданий.
III. Домашнее задание
Повторить § 1—3, записи в тетрадях, № 4 § 3.
Ответы
Теоретическая часть
1. Известны следующие модели строения атома:
«Пудинге изюмом» (1902—1904 г. Дж. Томсон);
«Планетарная» (1907 г. Э. Резерфорд);
«Модель Бора» (1913 г.)
2. Современная модель строения атома: атом — электронейтральная частица; ядро атома — положительно заряженное и электроны, которые вращаются вокруг ядра с определенной скоростью, имеющие двойственную природу, отрицательно заряженные.
3. Ядро атома состоит из протонов, имеющих массу 1, заряд +1, 4 нейтронов, имеющих массу I и заряд 0, заряд ядра определяется количеством протонов. Количество протонов соответствует порядковому номеру элемента в ПСХЭ Д.И. Менделеева.
Изотопы — совокупность атомов, имеющих одинаковое число протонов в ядре атома, но различающихся количеством нейтронов в ядре атома. Изотопы различны атомной массой (А). Число нейтронов определяется по формуле N = А - Z.
Z — порядковый номер элемента.
4. Частицы микромира: электроны, нейтроны, протоны — обладают свойствами, которые нельзя описывать законами механики для тел макромира. Наука квантовая механика дает объяснение двойственных свойств частиц микромира: электрон — это частица, имеющая определенную массу ml = 9 · 10-28, скорость движения 108 см/сек, заряд -1, а также проявляющая волновые свойства; эксперименты группы английских ученых в 1927 г. подтвердили явления дифракции и интерогеренции.
5. У частиц микромира, обладающих двойственными свойствами, можно лишь вычислить вероятность нахождения частицы в определенном объеме пространства, т.к. волновое движение есть движение по всему объему пространства, занимаемому волнами, для микрочастиц всегда имеются неопределенности в координате и импульсе, электронное облако — пространство около ядра атома, где сосредоточена вся масса электрона и электронная плотность. Атомная орбиталь — часть электронного облака, где сосредоточено более 90 % электронной плотности; радиус АО — расстояние от ядра атома до максимальной электронной плотности.
6. Известны энергетические — квантовые — числа, которые описывают состояние электрона в атоме:
n — главное квантовое число, характеризует общую энергию электрона данного энергетического уровня, номер периода ПСХЭ соответствует количеству энергетических уровней в атоме, я принимает целые значения;
l — побочное квантовое число; уточняет запас энергии электрона на энергетическом уровне, характеризует энергию связи е с ядром, а также форму АО. Принимает значения от 0 до n - 1;
l = 0 — подуровень s, форма орбитали сферическая;
l = 1— подуровень р, объемная форма орбитали;
l = 2 — подуровень d, более сложная форма орбитали;
l = 3 — подуровень f более сложная форма орбитали.
Номер энергетического уровня соответствует количеству подуровней на данном энергетическом уровне.
ml — магнитное орбитальное квантовое число, соответствует распределению АО в пространстве около ядра, определяет количество АО, принимает значения от -1, 0, +1;
ms — магнитное спиновое квантовое число характеризует чисто квантовое свойство электрона; это собственный момент импульса электрона; абсолютное значение спина 1/2, проекция спина на ось (магнитное спиновое число) может иметь лишь два значения ms = +1/2; ms = -1/2.
7. Принцип минимальной энергии:
принцип Паули, правило Хунда, правило Клечковского.
При несоблюдении принципа Паули на АО в атоме были бы электроны с одинаковыми значениями всех квантовых чисел, т.е. в ячейки могут попасть электроны с параллельными спинами. При несоблюдении правила Хунда суммарный спин будет не максимальным, а это соответствует большему значению энергии атома. Такое состояние считается неустойчивым, что соответствует возбужденному состоянию атома.
8. Электронные семейства:
s-элементы, если заполняется s-подуровень;
p-элементы, если заполняется p-подуровень;
d-элементы, если заполняется d-подуровень;
f-элементы, если заполняется f-подуровень.
9. Электронная формула атома химического элемента показывает, как распределяются электроны в атоме, учитывая их характеристику квантовыми числами.
В электронной формуле указывается номер энергетического уровня, подуровни и количество электронов на подуровнях. Электронно-графическая формула показывает количество АО открытых на энергетических уровнях, подуровнях в виде ячеек, а также векторами в ячейках записываются электроны либо неспаренные, либо спаренные.
10. В атомах некоторых элементов электрон с s-подуровня внешнего энергетического уровня переходит на d-подуровень предвнешнего энергетического уровня. Идет выигрыш в энергии. Атом считается симметричным, т.е. либо большинство электронов становятся неспаренными, либо — спаренными.
Практическая часть
1.
|
Хим. элемент |
Заряд |
||||
|
№ |
название |
ядра |
протонов |
нейтронов |
электронов |
|
37 |
рубидий |
+ 37 |
37 |
85 - 37 = 38 |
37 |
|
50 |
олово |
+ 50 |
50 |
119 - 50 = 69 |
50 |
|
74 |
вольфрам |
+ 74 |
74 |
184 - 74 = 110 |
74 |
|
56 |
барий |
+ 56 |
56 |
137 - 56 = 81 |
56 |
|
80 |
ртуть |
+ 80 |
80 |
201 - 80 = 121 |
80 |
2. а) 1d — нет, так как n = 1, l = 0 — может быть открыт s-подуровень;
б) 5f — да, т. к. n = 5, l = 0, 1, 2, 3, 4 при l = 4 — f-подуровень;
в) 3р — да, т. к. n = 3; l = 0, 1, 2 при l = 1, р-подуровень;
г) 2d — нет, т. к. n = 2; l = 0, 1 могут быть открыты s-подуровень, p-подуровень;
д) 6d — да, т. к. n = 6, l = 0, 1, 2, 3, 4, 5 при l = 4, f-подуровень.
3. Са — 2p, 1p, 4p, 3d, 3s;
могут: 2р, 3s, 4s; нет: 1р, 4р, 3d;
Si — 4s, 2p, 3p, 2d, 3s;
2p, 3s, 3p — могут; не могут — 2d, 4s;
Вr — 1p, 2d, 2p, 4s, 3d;
могут — 2p, 4s, 3d; нет — 1p; 2d;
Mn — 1s, 2p, 3d, 4p, 4s;
могут — 1s, 2p, 3d, 4s; нет — 4p;
Sr — 6s, 3d, 4d, 4p, 2p;
могут — 2p, 3d, 4p; нет — 4d, 6s.
4. a) 3s2; n = 3 ⇒ элемент III периода; 2 e- — II группа; открыт s-подуровень — главная подгруппа. Это — Mg (магний).
б) 4s23d6; n = 4 ⇒ элемент IV периода; сумма электронов s + d = 8 ⇒ элемент VIII группы, d-подуровень заполняется, элемент побочной подгруппы. Это — Fe (железо).
в) 4s24p3; n = 4 ⇒ элемент IV периода; сумма s- и p-электронов 2 + 3 = 5 ⇒ V группа заполняется, p-подуровень — главная подгруппа. Это — As (мышьяк).
г) 5s24d1; n = 5 ⇒ элемент V периода, сумма электронов s и d 2 + 1 = 3 ⇒ элемент III группы, заполняется d-подуровень — побочная подгруппа. Это Y (иттрий).
д) 3s23р5; n = 3 ⇒ элемент III периода, сумма электронов s и р 2 + 5 = 7 ⇒ элемент VII группы, заполняется p-подуровень — главная подгруппа. Это — Cl (хлор).
Самостоятельная работа
Вариант I
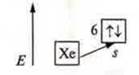
1. № 56, барий Ва:
заряд ядра +56; в атоме 56 е-.
n = 6, шесть энергетических уровней.
![]()
(повторяется структура ксенона)
2. a) 6s1; n = 6 ⇒ элемент IV периода, один электрон на внешнем уровне — элемент I группы;
заполняется s-подуровень ⇒ главная подгруппа.
Это — Cs (цезий);
б) 4s23d2; n = 4 ⇒ элемент IV периода; сумма s- и d-электронов 2 + 2 = 4 ⇒ элемент IV группы, так как заполняется d-подуровень — побочная подгруппа. Это — Ti (титан).
Вариант II
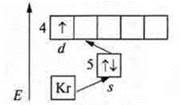
1. № 39 иттрий Y;
заряд ядра +39; в атоме 56 е-.
n = 5, шесть энергетических уровней.
2. a) 5s24d5; n = 5 ⇒ элемент пятого периода.
Сумма электронов s и d: 2 + 5 = 7 ⇒ это VII группа, заполняется d-подуровень ⇒ побочная подгруппа. Это — Тс (технеций).
б) 3s23p2; n = 3 ⇒ элемент III периода; сумма электронов s и р; 2 + 2 = 4 ⇒ IV группа; заполняется р-подуровень ⇒ главная подгруппа. Это — Si (кремний).