Поурочные разработки по химии 11 класс
Соединения неметаллов: водородные соединения, оксиды и гидроксиды - ВЕЩЕСТВА И ИХ СВОЙСТВА - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: научить правильно составлять формулы соединений неметаллов: оксидов, соответствующих им гидроксидов, водородных соединений, учитывая их возможные С.О.А., а также описывать их свойства и изменение в зависимости от строения атома, положения в ПСХЭ Д. И. Менделеева.
Основные понятия: основной характер, кислотный характер, окислитель, восстановитель, ковалентная полярная связь, полярность связи.
Ход урока
I. Организационный момент
Постановка целей и задач урока.
II. Проверка правильности выполнения домашнего задания
Выполнение домашнего задания у доски.
а) первый ученик: № 5, уравнения № 2, 9;
второй ученик: № 5. уравнения № 5, 10;
третий ученик: № 5, уравнения № 7, 6.
III. Фронтальная работа
б) после ответов учащихся у доски проверить с места выполнение всех оставшихся вопросов задания № 5 уравнений № 1, 3, 4, 8, 11, 12, 13.
в) решение задачи № 5.
Ответы на задание № 5 § 19

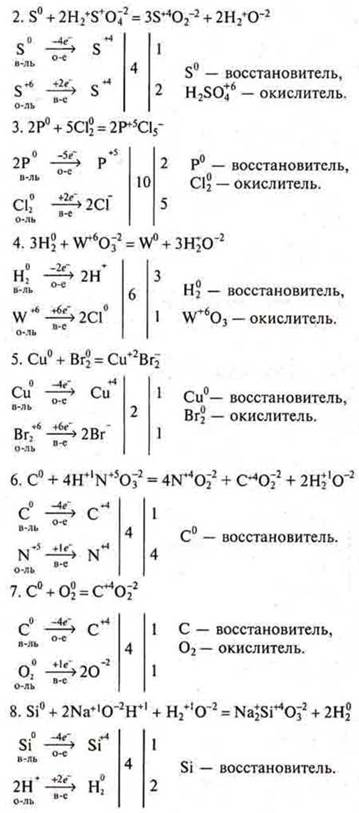

Задача № 12
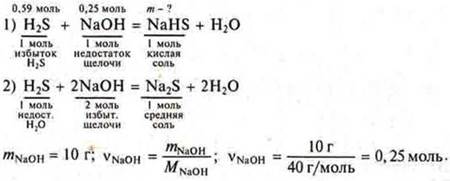
![]()
Согласно уравнению (1), видно, что H2S в избытке, т. к. на 0,25 моль NaOH требуется 0,25 моль H2S, а дано 0,59.
Расчеты ведем по уравнению (1):
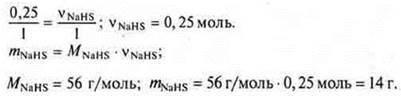
Ответ: vNaHS = 56 г моль; соль кислая, гидросульфид натрия.
IV. Изучение нового материала
План изложения
1. Водородные соединения неметаллов. Кислотно-основные и восстановительные свойства водородных соединений неметаллов.
2. Оксиды, образованные неметаллами. Кислотный характер оксидов неметаллов и изменение их в зависимости от положения элемента-неметалла, образующего его в ПСХЭ Д. И. Менделеева. Окислительные свойства оксидов.
3. Гидроксиды, образованные оксидами неметаллов. Изменение характера гидроксидов в зависимости от положения в ПСХЭ Д. И. Менделеева элемента-неметалла, образовавшего гидроксид. Окислительные свойства гидроксидов.
В учебнике на с. 236 в таблице представлены формулы водородных соединений, образованных неметаллами. Учащиеся вместе с учителями работают с этой таблицей, отвечая на вопросы.
Вопрос. В какой С.О. находятся неметаллы в водородных соединениях? По агрегатному состоянию больше газов?
Ответ: Так как ЭО неметаллов больше ЭО водорода, то они выступают в этих соединениях окислителями, проявляя максимальную С.О.: С-4, N-3, Р-3 и т. д. Большинство этих соединений — газы, летучие, легкоподвижные, быстроиспаряемые.
Вопрос. Есть ли среди водородных соединений есть ли известные вам? Знаете ли вы, как их можно получить?
Ответ: Известно много водородных соединений, изученных ранее: СН4 — метан, NH3 — аммиак, Н2О — вода, H2S — сероводород, HCl — хлороводород. Их можно получить непосредственно взаимодействием неметалла с водородом:

Вопрос. Какой вид химической связи присутствует в водородных соединениях? Какой тип кристаллической решетки им характерен? Как изменяется полярность связи по периоду и по группе, главной подгруппе?
Ответ: В водородных соединениях присутствует ковалентная полярная связь, они имеют молекулярную кристаллическую решетку.
Полярность связи зависит от разности и ЭО — чем она больше, тем полярнее связь.
Вопрос. Как изменяется полярность связи в периодах? В группах, главных подгруппах?
Ответ: Так как ЭО усиливается к концу периода, то, следовательно, полярность связи вырастает в водородных соединениях к концу периода. К концу группы главной по группы ЭО уменьшается, и полярность связи будет уменьшаться.
Пример: водородные соединения III периода расположены в порядке усиления полярной связи:
![]()
Усиление полярности связи
Водородные соединения VII группы, главной подгруппы в порядке усиления полярности связи:
![]()
Усиление полярности связи
Вопрос. Влияет ли полярность связи на растворимость водородного соединения в воде? Почему?
Ответ: Влияет, т.к. молекулы воды сильно полярны, и чем полярнее молекула, тем более сильное возникает межмолекулярное взаимопритяжение с образованием водородных связей.
Вопрос. Какие соединения образуются при растворении водородных соединений III периода в воде? Какой характер — кислотный или основной — им соответствует? И как он изменяется к концу периода?
Ответ: ![]()
При растворении в воде не наблюдается проявления кислотноосновного характера у SiH4, он сразу сгорает в кислороде; РН3 — дает очень слабую основную реакцию; H2S — дает слабокислую реакцию; НСl — сильнокислую реакцию, т. к. от SiH4 до НСl радиус иона неметалла уменьшается, а заряд — возрастает, полярность связи в молекулах возрастает, все это вызывает усиление кислотного характера.
К концу периода усиливается кислотный характер водородного соединения.
Вопрос. Как изменяется кислотно-основной характер водородных соединений неметаллов в группах главных подгруппах?
Ответ: Кислотно-основные свойства водородных соединений неметаллов одной подгруппы отличаются. Прочность связи Н—Э уменьшается, т. к. увеличивается длина связи.
Пример: водородные соединения VII группы главной подгруппы HF, НСl, НВr, HI; НСl, НВr, HI — это сильные кислоты, диссоциируют полностью. Сила кислоты увеличивается от HF к HI. HF— самая слабая кислота. Одна из причин — самый маленький радиус у F, другая причина — возникновение межмолекулярных водородных связей ...Н—F...Н—F..., что говорит о том, что атом водорода связан не только с атомом F своей молекулы, но еще и соседней.
Вывод: В периодах и группах, главных подгруппах с увеличением заряда ядер элементов-неметаллов усиливаются кислотные, ослабевают основные свойства.
Следует отметить, что водородные соединения в ОВР всегда проявляют восстановительные свойства, т. к элемент-неметалл — в минимальной С.О.
Пример:

В оксидах неметаллов элемент-неметалл имеет положительную С.О. Один и тот же элемент, имея несколько положительных С.О., может образовать несколько оксидов.
Пример:

Чем выше С.О. элемента-неметалла в оксиде, тем сильнее кислотный характер оксида.
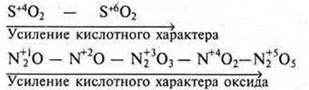
Оксиды неметаллов — это соединения с полярной ковалентной связью. Типы кристаллических решеток — молекулярные: СO2, SO3; атомные — SiO2.
К концу периода усиливается кислотный характер оксида.
Пример:
![]()
Усиливается кислотный характер оксида
В группах, главных подгруппах кислотный характер оксидов ослабевает.
Пример:
![]()
Кислотный характер оксида ослабевает
![]()
Увеличивается радиус иона неметалла,
С.О. не изменяется
Вывод: Все солеобразуюшие оксиды, образованные неметаллами, обладают кислотными свойствами. Сила кислотного характера зависит от С.О. элемента-неметалла и его атомного радиуса.
Оксидам неметаллов соответствуют гидроксиды — кислородсодержащие кислоты. Изменение силы кислоты зависит от С.О. и радиуса атома элемента-неметалла. Мы рассматривали изменение характера оксидов, образованных одним и тем же элементом.
Пример:
![]() — оксиды азота (III, V)
— оксиды азота (III, V)
![]()
Усиливается кислотный характер
Данным оксидам соответствуют гидроксиды кислоты:
![]()
Сила кислоты изменяется так же, как и у оксидов, усиливается с возрастанием С.О. и радиуса атома неметалла.
Пример: оксиды хлора (I, III, V, VII).
![]() — оксиды хлора (I—VII)
— оксиды хлора (I—VII)
![]()
Усиление кислотного характера гидроксидов — кислот
В периодах с увеличением заряда ядра атома элемента-неметалла наблюдается усиление кислотных свойств гидроксидов, образованных оксидами неметаллов:
![]()
Усиливается кислотный характер гидроксида
![]()
Возрастает С.О.; радиус иона неметалла уменьшается
В группах, главных подгруппах кислотный характер гидроксидов, образованные оксидам неметаллов, ослабевает.
![]()
Ослабевает кислотный характер гидроксила,
![]()
Радиус иона неметалла возрастает, С.О. не изменяется
Все оксиды и гидроксиды, образованные элементами в максимальной С.О. всегда окислители.
Пример:
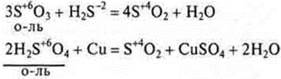
Если в оксиде и гидроксиде элемент-неметалл проявляет промежуточную С.О., то данные соединения в зависимости от условий могут быть и окислителями, и восстановителями.
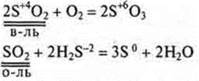
V. Домашнее задание
§ 19. Выполнить задания по вариантам на отдельных листках на оценку.
I. № 8 (2), № 9 (1), задача 14.
II. № 8 (4), № 4 (2), задача 15.
VI. Закрепление № 11 § 19.
СО2 и SiО2
Сходство: кислотные оксиды, солеобразующие, связь ковалентная полярная, SP-гибридизация, линейная форма молекул.
Различие: СО2 — газ, SiО2 — твердое вещество. Тип кристаллической решетки: СО2 — молекулярная, SiО2 — атомная.
ЭОС = 2,5 ЭОО = 3,5 SiО2 — связь более полярная
ЭОSi = 1,8
Более кислотный характер проявляет СО2, чем SiО2, т. к. радиус атома С меньше радиуса атома Si.
![]() — угольная кислота,
— угольная кислота,
![]() соответствует H2SiО3 — кислота твердая кремниевая,
соответствует H2SiО3 — кислота твердая кремниевая,
H2SiО3 — нерастворимая,
Н2СО3 — слабая кислота угольная, растворимая.
Однако кислота угольная сильнее кремниевой. Она взаимодействует, как и все кислоты, с металлами, оксидами металлов, основаниями растворимыми.
Сходство: это двухосновные кислородсодержащие кислоты, С.О. элемента-неметалла одинаковая +4, очень слабые электролиты.