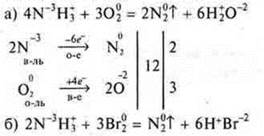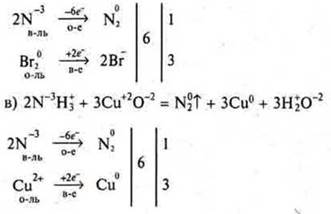Поурочные разработки по химии 11 класс
Неметаллы - ВЕЩЕСТВА И ИХ СВОЙСТВА - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: обобщить сведения об особенностях строения атомов неметаллов; научить определять степени окисления; закрепить знание особенностей строения, физических и химических свойств простых веществ — неметаллов; закрепить умение составлять уравнения химических реакций, характеризующих свойства неметаллов.
Основные понятия: неметалличность, ковалентная связь, атомная и молекулярная кристаллическая решетка, окислитель, восстановитель, окисление, восстановление; электроотрицательность, аллотропия.
Оборудование: таблицы «Химическая связь», «Кристаллические решетки»; модели кристаллических решеток; неметаллы: S, Si; Р (красный); Br2; Ki; Zn, HCl, СuО; прибор для получения газа.
Ход урока
I. Организационный момент
Постановка целей и задач урока.
II. Проверка правильности выполнения домашнего задания
Учитель акцентирует внимание учащихся на условиях задач, в которых предложены разные типы: задачи на «избыток» и «недостаток» — № 28, 30; задачи на смеси — № 31, 32.
В целях экономии времени урока на кодотранспоранте предложить учащимся сверить решения задач № 28, 29, 30. Решение задач на смеси: № 31 и 32 — учитель объясняет учащимся.
Задача № 28
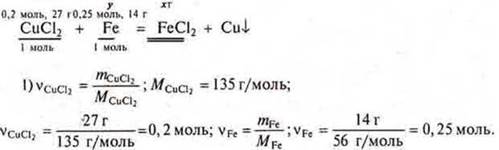
![]() моль железа требуется, а дано 0,25 моль ⇒ Fe в избытке. СuСl2 — недостаток, расчет ведем по недостатку.
моль железа требуется, а дано 0,25 моль ⇒ Fe в избытке. СuСl2 — недостаток, расчет ведем по недостатку.
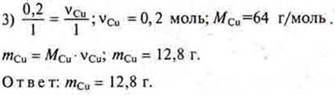
Задача № 29
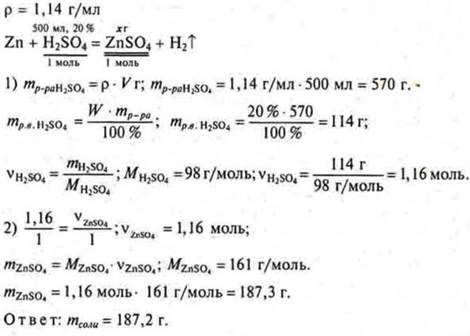
Задача № 30

Задача № 31.
Краткое условие:
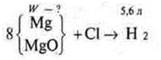
Решение:
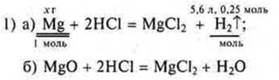
Из уравнения «а» ![]()
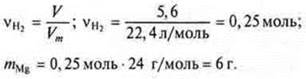
Т. к. реакция «б» не дает водорода, то сразу определяем WMg в смеси
![]()
Ответ: WMg в смеси = 75 %.
Задача № 32.
Краткое условие:
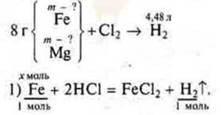 Примем
Примем ![]()
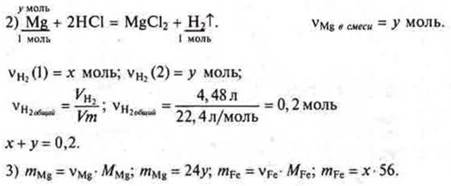
Составляем уравнение 56х + 24у = 8.
4) система уравнений ![]()
Решаем систему уравнений:
х = 0,1 моль, mFe = 5,6 г.
У = 0,1 моль, mMg = 2,4 г.
Ответ: mFe = 5,6 г; mМе = 2,4 г.
(Учащимся предлагается решить задачу № 38 дома.)
III. Изучение нового материала
План изложения
1. Химические элементы — неметаллы:
а) Положение элементов — неметаллов в ПСХЭ Д. И. Менделеева.
б) Особенности строения атомов неметаллов. Возможные степени окисления. Изменение неметалличности в периодах и в группах главных подгрупп.
в) Электроотрицательность (ЭО). Изменение ЭО в периоде и в группах главных подгруппах ПСХЭ с увеличением заряда ядра атома.
2. Простые вещества — неметаллы:
а) Химическая связь, кристаллические решетки.
б) Физические свойства неметаллов; аллотропия.
в) Химические свойства неметаллов.
г) Получение и применение.
В ПСХЭ неметаллы расположены справа и вверх от диагонали, проведенной от бора к астату. То есть они расположены в главных подгруппах III, IV, V, VI, VII, VIII групп. На внешнем энергетическом уровне атомы неметаллов имеют электронов четыре и более четырех. Водород и гелий — это s-элементы, все остальные неметаллы — это p-элементы. Инертные газы имеют завершенный внешний энергетический уровень, все остальные атомы неметаллов имеют внешний энергетический уровень близкий к завершению. До устойчивости они принимают недостающее количество электронов, приобретая тем самым сходство с внешним энергетическим уровнем инертных газов. Октет — 8 электронов, у Не (гелия) два.
В периодах с увеличением заряда ядра атома элемента увеличивается количество электронов внешнего энергетического уровня, вследствие чего атомный радиус атома уменьшается, усиливается неметалличность — способность принимать электроны. В группах, главных подгруппах с увеличением заряда ядра атома увеличивается количество энергетических уровней, т. е. возрастает атомный радиус атома, а количество электронов на внешнем энергетическом уровне остается неизменным. К концу группы главной подгруппы неметалличность уменьшается.
Способность принимать электроны — это проявление окислительных свойств атомов элементов. Таким образом, окислительные свойства неметаллов усиливаются к концу периода и к началу группы главной подгруппы.
Для количественной характеристики используется важное понятие электроотрицательность (ЭО). Максимальное значение ЭО имеет F, оно равно 4. Это самый неметаллический элемент, сильнейший окислитель.
У остальных неметаллов значение ЭО изменяется от 2 до 4 и в соответствии с этими значениями они располагаются в ряду ЭО (форзац учебника, с. 229).
Сравнивая значения ЭО неметаллов, делаем вывод, что один и тот же элемент в зависимости от расположения в ряду ЭО по отношению к одним элементам проявляет себя как окислитель, к другим — как восстановитель.
Пример: S — сера, проявляет окислительные свойства по отношению к левее расположенным элементам; в ряду ЭО S проявляет восстановительные свойства по отношению к элементам, правее расположенным в ряду ЭО.
Возможные С.О. неметаллов зависят от особенности строения атомов в основном и в возбужденном состоянии.
Пример: Р — фосфор.
Основное состояние:
Р + 15; 1s22s22p63s23p33d0
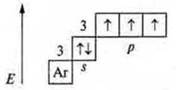
До устойчивости внешнего энергетического уровня атом фосфора принимает 3е-.
![]()
С.О. -3, минимальная. Р — окислитель. Может отдать 3е-.
![]()
С.О. +3 промежуточная. Р — восстановитель и окислитель.
У атома фосфора на третьем энергетическом уровне возможно открытие d-подуровня и в возбужденном состоянии возможно распаривание 3s2-электронов за счет энергии извне (например на свету).
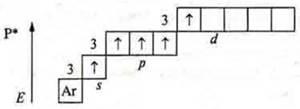
![]()
восстановитель.
С.О. +5, максимальная, она соответствует номеру группы.
Вывод: В зависимости от строения атома неметаллы могут принимать С.О. минимальную, максимальную и промежуточные. Принимая минимальную С.О., они выступают как окислители: ![]()
![]() Принимая максимальную С.О., они выступают как восстановители:
Принимая максимальную С.О., они выступают как восстановители: ![]()
Атомы-неметаллы образуют молекулы простых веществ, как правило, двухатомные. Химическая связь — ковалентная неполярная кристаллические решетки могут быть атомные и молекулярные.
Пример:
Н2 — водород, O2 — кислород; Сl2 — хлор; I2— йод, С — алмаз;
Н2, O2, Сl2 — газы, молекулярные кристаллические решетки;
I2 — твердое вещество;
С — алмаз — атомная кристаллическая решетка.
Атомы-неметаллы, имеющие несколько неспаренных электронов, могут образовывать несколько молекул простых веществ. Такое явление называется аллотропией, а простые вещества — аллотропными видоизменениями.
Пример:
O2 — кислород, O3 — озон;
S8 — сера кристаллическая, Sn — сера пластическая;
Р — красный фосфор, Р4 — белый фосфор;
С — углерод, алмаз, графит, карбин, фуллерены.
Чем больше в атоме неспаренных электронов, тем больше возможность образования аллотропных видоизменений.
Физические свойства неметаллов и металлов значительно различаются.
Например, цвет: I2 — фиолетовый (пары), черный с металлическим блеском (тв.); Вr2 — бурый; Р4 — бледно-желтый, Р — красный; O2 (жидк.) — голубой; Сl2 (газ) — зеленый.
В зависимости от типа кристаллической решетки у неметаллов могут быть и общие, и отличительные физические свойства. Газообразные неметаллы, жидкий бром, кристаллы — диэлектрики, кристаллы — непластичны; большинство неметаллов имеют металлический блеск: I2, Si, С (графит).
Химические свойства неметаллов следует рассматривать как окислительно-восстановительные, согласно их ЭО. Однако по отношению к водороду и металлам они все окислители.
Пример:
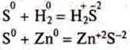
В обоих случаях ![]() S — сера — окислитель.
S — сера — окислитель.
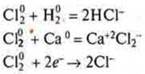
Сl20 — хлор, окислитель.
![]()
N20 — азот, окислитель: ![]()
Если рассматривать взаимодействие неметаллов друг с другом, то следует учитывать их ЭО. Пример:
![]()
N2 — азот, восстановитель: ![]()
Неметаллы взаимодействуют и со сложными веществами — неорганическими и органическими, выступая как окислители или восстановители.
Эксперимент: Неметаллы-окислители.

б) реакция горения:
![]() O2 — окислитель.
O2 — окислитель.
![]() O2 — окислитель.
O2 — окислитель.
![]() Сl2 (хлор) — окислитель.
Сl2 (хлор) — окислитель.
Эксперимент: Неметаллы-восстановители.
![]() Н20 — восстановитель,
Н20 — восстановитель,
 Н20 — восстановитель.
Н20 — восстановитель.
 Н2 - восстановитель.
Н2 - восстановитель.
В заключение учитель с учащимися составляет таблицу.
Химические свойства неметаллов
|
Неметаллы |
|
|
Окислители |
Восстановители |
|
а) + металлы б) + неметаллы с меньшей ЭО в) + сложные вещества (оксиды, кислоты, соли, водородные соединения, органические вещества) |
а) + неметаллы с большей ЭО б) + сложные вещества (соли, оксиды, кислоты, органические соединения) |
Получение неметаллов:
а) Электролиз расплавов солей:
галогениды:
![]()
б) Вытеснение из солей более активным галогеном:
![]()
в) Из жидкого воздуха: O2; N2; O3;
г) В природе: С, S;
д) S — кремний из SiO2:
![]()
е) Р — фосфор
![]()
ж) Se — селен и Те — теллур из отходов производства серной кислоты в виде примесей в составе руды FeS2.
з) Н2 — конверсия метана:
водород: ![]()
и) В — бор: ![]()
III. Домашнее задание
§ 19 до с. 236, № 3, 5, с. 242, задача № 12.
IV. Закрепление
Выполнить задание № 10, с. 242.
Выполняют: I ряд — «а)», II ряд — «б)». III ряд — «в)».