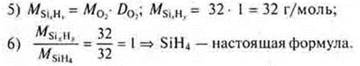Поурочные разработки по химии 11 класс
Зачет по теме «Неметаллы» - ВЕЩЕСТВА И ИХ СВОЙСТВА - ПОУРОЧНЫЕ РАЗРАБОТКИ ПО ХИМИИ 11 класс - поурочные разработки - разработки уроков - авторские уроки - план-конспект урока - химия
Цели урока: проверить знания и умения по теме «Неметаллы».
Оборудование: карточки-задания на два варианта.
Ход урока
I. Организационный момент
Инструктаж учащихся о ходе выполнения заданий зачета. Рекомендация учителю
В момент выполнения зачета учитель проверяет выполнение домашнего задания в рабочих тетрадях, выставляя оценки.
II. Выполнение зачета по карточкам-заданиям на два варианта
|
Вариант I |
Вариант II |
|
1. Особенности строения атома неметалла |
|
|
хлора |
серы |
|
Объяснить их возможные С.О. в основном и возбужденном состоянии. |
|
|
2. Сравнить неметалличность элементов |
|
|
Cl, Вr, I, F |
Р, S, Cl, Si |
|
Расположить элементы в порядке: |
|
|
Возрастания неметалличности |
Убывания неметалличности |
|
Дать обоснованный ответ. |
|
|
3. Какая химическая связь и какой тип кристаллической решетки у неметаллов — простых веществ? |
|
|
Бор, водород, ио. |
Алмаз, бром, кислород |
|
4. Возможна ли аллотропия у: |
|
|
а) хлора. б) углерода; |
а) фосфора; б) брома. |
|
Дать обоснованный ответ. |
|
|
5. На примере соответствующих уравнений реакций |
|
|
|
|
|
Объяснить, в каком случае |
|
|
фосфор |
сера |
|
проявляют: |
|
|
а) окислительные свойства; |
б) восстановительные свойства |
|
6. Сравнить кислотные свойства: |
|
|
а) НСl и H2S. б) SO2 и SO3. в) H2SO4 и НСl4. |
а) НСl и HF; б) Сl2O и Сl2O7; в) НСl2O4 и НВrO4. |
|
и объяснить причину их различий. |
|
|
7. Сравнить основные свойства |
|
|
NH3 и Н2O |
РН3 и NH3 |
|
и объяснить причину их различий. |
|
|
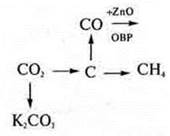
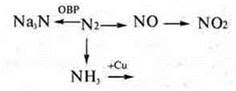
8. Составить уравнения реакций по схеме превращений |
|
|
|
|
|
9. Решить расчетные задачи на выведение формулы соединения. |
|
|
1) При сжигании углеводорода массой 11,2 г получили 35,2 г оксида углерода (IV) и 14,4 г воды. Относительная плотность углеводорода по воздуху равна 1,93. Найдите молекулярную формулу углеводорода. 2) Выведите формулу газообразного соединения, массовая доля азота в котором 82,36%, а водорода — 17,64%. Относительная плотность его по водороду 8,5. |
1) Найдите молекулярную формулу углеводорода, если при сжигании 2 г его образовалось 2,12 г воды и 6,48 г оксида углерода (IV). Относительная плотность паров этого вещества по водороду равна 34. 2) Выведите формулу газообразного соединения, массовая доля кремния в котором 87,5 %, а водорода — 12,5 %. Относительная плотность его по кислороду 1. |
Ответы на вопросы зачета
Вариант I
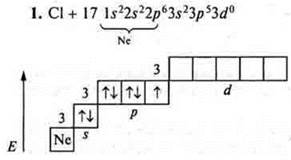
На внешнем энергетическом уровне семь электронов, три пары спаренных и один неспаренный. Уровень близок к завершению, до устойчивости принимается один электрон; хлор проявляет С.О. -1, +1 в основном состоянии. У атома хлора возможно открытие 3d-подуровня в состоянии возбуждения. Возможно распаривание 3рх, 3ру, 3s-электронов. Хлор проявляет:
С.О. +3 (первое возбуждение);
С.О. +5 (второе возбуждение);
С.О. +7 (третье возбуждение).
2. В порядке возрастания неметалличности I, Br, Cl, F. Это элементы VII группы, главной подгруппы. Неметалличность усиливается к началу группы, главной подгруппы, т. к. радиус атома уменьшается количество электронов на внешнем энергетическом уровне не изменяется.
3. Бор, водород, йод — ковалентная неполярная связь. Бор — атомная кристаллическая решетка. Водород, йод — молекулярная кристаллическая решетка.
4. У хлора невозможна аллотропия, так как в атоме хлора один неспаренный электрон.
У атома углерода в состоянии возбуждения — четыре неспаренных электрона. Возможна аллотропия в виде: алмаз — sр3-гибридизация, графит — sр2-гибридизация, карбин — sp-гибридизация.

6. а) НСl и H2S — водородные соединения элементов III периода водородных соединений, кислотные свойства усиливаются к концу периода
![]()
HCl как кислота сильнее H2S.
б) S+4O2 и S+6O3 — солеобразуюшие оксиды. С.О. у серы в SО2 +4, у серы в SО3 +6; чем выше С.О., тем сильнее выражены кислотные свойства оксида. Таким образом, кислотные свойства SО3 сильнее кислотных свойств SО2.
в) H2S+6О4 и НСl+7О4 кислородсодержащие кислоты, образованы элементами-неметаллами, расположенными в III периоде. Сила кислот кислородсодержащих возрастает к концу периода.
НСl+7О4 сильнее H2S+6O4. С.О. Сl+7 больше С.О. S+6, радиус ион Сl+7 меньше радиуса иона S+6.
7. Основные свойства NH3 выражены сильнее, чем Н2O, т. к. в дородные соединения образованы элементами N и О, расположенными во II периоде. Основные свойства к концу периода ослабевают, т. к. возрастает С.О. и уменьшается радиус иона неметалла.
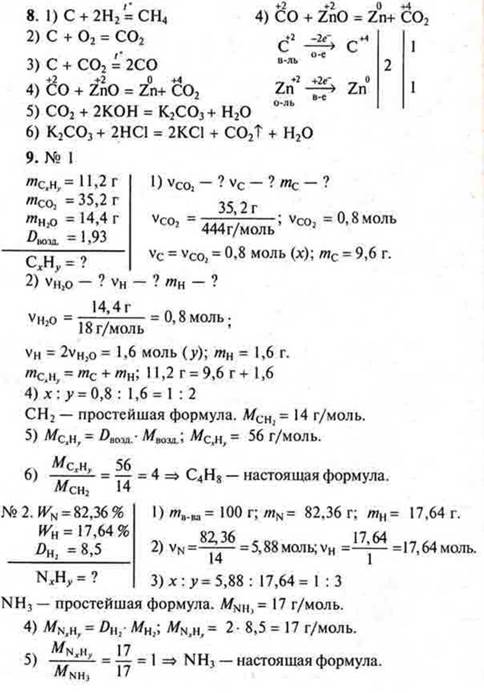
Вариант II
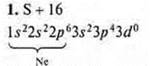
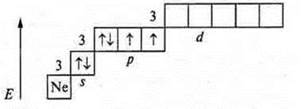
На внешнем энергетическом уровне шесть электронов, две пары спаренных и два неспаренных. Уровень близок к завершению, до устойчивости принимается два электрона. Сера проявляет С.O. в основном состоянии -2; +2.
У атома серы возможно открытие 3d-подуровня, в состоянии возбуждения возможно распаривание 3рх, 3s электронов. Сера проявляет:
С.О. +4 (первое возбуждение); С.О. +6 (второе возбуждение).
2. В порядке убывания неметалличности Р, S, Cl, Si. Это элементы III периода. К концу периода неметалличность усиливается, а к началу периода убывает, так как возрастает атомный радиус, уменьшается заряд ядра атома, уменьшается количество электронов на внешнем энергетическом уровне.
![]()
убывание неметалличности
3. Алмаз, бром, кислород — ковалентная неполярная связь.
Алмаз — атомная кристаллическая решетка.
Бром, кислород — молекулярная кристаллическая решетка.
4. У фосфора возможна аллотропия, т. к. в основном состоянии в атоме фосфора три неспаренных электрона: Р — красный, Р4 — белый.
В атоме брома один неспаренный электрон, аллотропия невозможна.

6. а) НСl и HF — водородные соединения элементов VII группы, главной подгруппы. Кислотные свойства водородных соединений к концу группы, главной подгруппы усиливаются, т. к. возрастает радиус ионная, а С.О. не изменяется. НСl как кислота сильнее HF.
б) Сl2+1O и Сl2+7O7 — оксиды, солеобразующие. С.О. в Сl2О +1, в Сl2O7 +7. Чем больше С.О. элемента, тем сильнее выражены кислотные свойства. Кислотные свойства Сl2O7 сильнее, чем у Сl2O.
в) НСl+7O4 и НВr+7O4 — кислородсодержащие кислоты. Они образованы элементами VII группы, главной подгруппы. Сила кислородсодержащих кислот к концу группы ослабевает, т. к. С.О. элемента не изменяется, а радиус иона к концу группы возрастает. Кислота НСlO4 сильнее кислоты НВrO4.
7. Основные свойства NH3 выражены сильнее основных свойств РН3. Соединения водородные образованы элементами одной V группы, главной подгруппы. К концу группы усиливаются кислотные свойства водородных соединений, основные свойства ослабевают, т. к. радиус иона возрастает, а С.О. не изменяется.

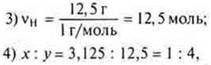
SiH4 — простейшая формула. MSiH3 = 32 г/моль;